微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子反应方程式正确的是( ? )
A.碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
B.氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+
C.硫酸亚铁溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
D.Fe3O4溶于稀硫酸:Fe3O4+8H+=3Fe3++4H2O
2、填空题 (14分)钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
|
上述盐溶液中的阴离子,结合H+能力最强的是_______ _,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1 mol/L NaHCO3 ②100ml 0.1 mol/L Na2CO3两种溶液,溶液中水电离出的H+个数:
① ②(填“>”、“=”或“<”,下同)。溶液中阴离子的物质的量浓度之和:① ②
(3)NaHCO3是一种 (填“强”或“弱”)电解质;写出HCO3
3、填空题 (12分)(1)现用氯化铜晶体(CuCl2.2H2O,含少量FeCl2杂质)制取纯净的CuCl2.H2O先将其制成水溶液,后按如图步骤进行提纯:
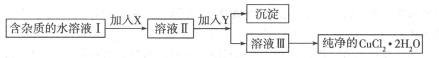
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表[来源:91exam.org]
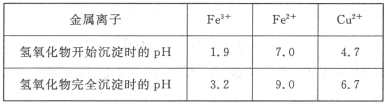
请回答下列问题:
①请从下列物质中选出第一步中需加入的X
a.NaClO b.H2O2
c.KMnO4 d.HNO3
②如何检验溶液Ⅱ中除Cu2+外的金属阳离子:________________________________。
③由溶液Ⅲ得到CuCl2.2H2O晶体的操作是___________________________________.
(2)某化学兴趣小组取一定量的双氧水,欲准确测定其中H2O2的含量:
取双氧水25. 00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准溶液滴定,其反应的离子方程式为: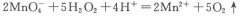
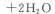
(1)滴定时,将高锰酸钾标准溶液注入________(填“酸式”或“碱式”)滴定管中,滴定到达终点的现象是________________________________________________
(2)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____(填“偏高”或“偏低”或“不变”)。
4、选择题 下列电离方程式中,正确的是( ? )
A.Na2SO4═2Na++SO4-2
B.Al2(SO4)3═2Al3++3SO42-
C.Ba(OH)2═Ba2++(OH-)2
D.CuSO4═Cu2++S6++4O2-
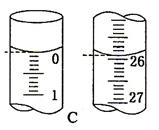
5、实验题 (12分)某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如
下几步:
A 移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B 用标准溶液润洗滴定管2-3次
C 把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面刻度
(1) 正确操作的顺序是(用序号字母填写) B- 。
(2) 滴定开始后,眼睛注视 ,判断滴定终点的现象是:
(3) 下列操作中可能使所测盐酸的浓度数值偏高的是
A 碱式滴定管未用标准溶液润洗就直接注入标准液
B 滴定前盛放HCl的锥形瓶用蒸馏水洗净后有少量水残留
C 碱式滴定管在滴定前有气泡,滴定后气泡消失
D 读取氢氧化钠溶液时,开始仰视读数,滴定结束时俯视读数
(4)滴定开始和结束时,碱式滴定管中的液面如图C所示,则终点读数为 mL,所测盐酸溶液的浓度为 mol/L。