微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有关元素X、Y、Z、W的信息如下:
元素
| 有关信息
|
X
| 原子半径为0.074 nm,其氢化物的结构模型可表示为:
|
Y
| 原子半径为0.102 nm,其原子核外电子排布为: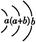
|
Z
| 人体中必需微量元素中含量最多,体内缺失会引起贫血
|
W
| 所在主族序数与所在周期序数之差为4
|
?
请回答下列问题:
(1)W在元素周期表中的位置是?。
(2)Y与W相比,非金属性较强的是?(填元素符号),下列事实能证明这一结论的是?(填字母)。
a.W元素氢化物的稳定性大于Y元素氢化物的稳定性
b.W元素氢化物水溶液的酸性强于Y元素氢化物水溶液的酸性
c.W元素的单质能与Y元素的氢化物反应,置换出Y单质
d.W的最高价含氧酸比Y的最高价含氧酸的酸性强
(3)Z元素和X元素可形成离子Z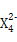 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
①Z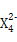 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。
②含该离子的盐用作絮凝剂的原因是(用离子方程式和简要的文字说明)?。
参考答案:(1)第3周期ⅦA族 (2)Cl a、c、d
(3)Fe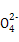 的还原产物为Fe3+,能发生水解反应,Fe3++3H2O
的还原产物为Fe3+,能发生水解反应,Fe3++3H2O Fe(OH)3(胶体)+ 3H+ ,生成的氢氧化铁胶体有吸附作用,起到净水作用
Fe(OH)3(胶体)+ 3H+ ,生成的氢氧化铁胶体有吸附作用,起到净水作用
本题解析:由X的氢化物的结构模型可知X为O;由Y的原子核外电子排布可知a=2,b=6,即Y为S;根据表中Z的有关信息可知Z为Fe;又因W所在主族序数与所在周期序数之差为4,可推知W应为Cl,故(1)Cl在第3周期ⅦA族;(2)非金属强弱的判断方法有:气态氢化物的稳定性,其最高价含氧酸的酸性强弱、非金属之间的置换反应,故a、c、d正确;(3)Z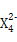 即Fe
即Fe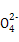 的还原产物为Fe3+,能发生水解反应,Fe3++3H2O
的还原产物为Fe3+,能发生水解反应,Fe3++3H2O Fe(OH)3(胶体)+3H+,生成的Fe(OH)3胶体具有吸附作用,起到净水作用。
Fe(OH)3(胶体)+3H+,生成的Fe(OH)3胶体具有吸附作用,起到净水作用。
本题难度:一般
2、填空题 (15分)下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:

| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
1
| A
| ?
|
2
| ?
| ?
| ?
| D
| E
| ?
| G
| ?
|
3
| B
| ?
| C
| J
| F
| ?
| H
| I
|
?
(1)表中元素,化学性质最不活泼的是?,只有负价而无正价的元素是?, 可用于制半导体材料的元素是_______
(2)C元素在元素周期表中的位置是?周期?族。
(3)最高价氧化物的水化物碱性最强的是?,酸性最强的是?,呈两性的是?;
(4)A分别与E、G、H形成的化合物中,最稳定的?;
(5)在B、C、E、F中,原子半径最大的是?.
(6)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式?。
(7)B、H两种元素形成的化合物所含的化学键类型为??
(8)写出C的最高价氧化物与H的氢化物之间反应的离子方程式_________________。
参考答案:

本题解析:略
本题难度:简单
3、选择题 X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A.原子半径:Z>Y>X
B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2
参考答案:B
本题解析:Ca2+的核外电子数为18,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构说明X、Z能形成负1价离子,故X为H、Z为F,而X不可能为F、Z不可能为Cl;由此可进一步推出Y为O。原子半径:O>F>H,A项错误;HF分子间存在氢键,故其沸点是同主族元素氢化物中最高的,B项正确;CaO2与水发生反应时,O22-歧化,既作氧化剂,又作还原剂,C项错误;CaO2中的阳离子与阴离子个数比均为1:1,D项错误。
【考点定位】本题考查短周期元素的性质推断和元素周期表知识。
本题难度:一般
4、选择题 砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是(?)
A.砷在通常情况下是固体
B.可以存在-3、+3、+5等多种化合价
C.砷的还原性比磷弱
D.As2O5对应水化物的酸性比H3PO4弱
参考答案:C
本题解析:同主族自上而下非金属性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱,D正确。同主族元素性质和结构是相似的,所以AB都是正确的。非金属性越强,相应阴离子的还原性越弱,所以选项C是错误的。答案选C。
本题难度:简单
5、填空题 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)用电子式表示X与W组成的化合物的形成过程?;
(2)由X与Z组成的某化合物中存在非极性键,则该化合物的分子式为?;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液不能与铜反应,浓溶液能与铜在加热条件下反应,该反应的化学方程式为:?;
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH浓溶液反应的离子方程式:?;
②又知A既能与盐酸反应,又能与氯水反应,写出与盐酸反应的离子方程式:?;
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1molB中含有6 mol结晶水。对化合物B进行如下实验:
取B的溶液加入足量的NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
另取B的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
由上述实验现象可知:B的化学式为?。
参考答案:(12分)(1)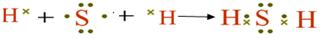
(2)H2O2?(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)①NH4++OH- NH3↑+H2O? ②SO32- + 2H+= SO2↑+H2O
NH3↑+H2O? ②SO32- + 2H+= SO2↑+H2O
(5)Fe SO4 ·(NH4)2 SO4·6H2O
本题解析:在周期表中X是原子半径最小的元素,所以X是氢元素。是Y的原子序数是a,则根据Y、Z左右相邻,Z、W位于同主族可知,Z的原子序数是a+1,W的原子序数是a+9,则1+a+a+1+a+9=32,解得a=7,所以Y是氮元素,Z是氧元素,W是S元素。
(1)S和H形成的化合物是共价化合物,其形成过程是
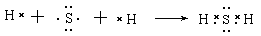 。
。
(2)H和O形成的含有非极性键的是双氧水,化学式是H2O2。
(3)该强酸是硫酸,浓硫酸和铜反应的化学方程式是Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(4)①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,这说明A应该是铵盐。其中氨气的物质的量是2mol,所以A是硫酸铵,因此该反应的离子方程式是NH4++OH- NH3↑+H2O。
NH3↑+H2O。
②A既能与盐酸反应,又能与氯水反应,这说明A应该是亚硫酸氢钠,具有还原性,所以反应的离子方程式是SO32- + 2H+=SO2↑+H2O。
(5)取B的溶液加入足量的NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色,这说明B中含有NH4+和亚铁离子。另取B的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,这说明B中还含有SO42-,因此B的化学式Fe SO4·(NH4)2 SO4·6H2O。
点评:本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。该题还需要注意的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:一般