微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 美国等国家发射的航空器将我国研制的磁谱仪带入太空,其目的是探索反物质。反物质的主要特征是电子带正电荷,质子带负电荷。下列表示反物质酸碱中和反应的离子方程式正确的是(?)
A.H-+OH+====H2O
B.H++OH====+H2O
C.H-+OH-====H2O
D.H++OH-====H2O
参考答案:A
本题解析:本题涉及的内容具有前沿性,我们对此不熟悉。但是,它从另一个角度表达了原子的主要构成微粒及其电性关系。构成反物质的原子称为反原子,反原子与原子的不同之处就是质子和电子所带的电荷性质恰好分别相反,氢原子失去带正电荷的电子形成阴离子H-,氧原子和氢原子各1个构成的原子团获得1个带正电荷的电子形成阳离子OH+,所以A选项是正确的。
本题难度:简单
2、选择题 元素周期律的实质是
A.相对原子质量逐渐增大
B.核电荷数逐渐增大
C.核外电子排布呈周期性变化
D.元素化合价呈周期性变化
参考答案:C
本题解析:元素周期律的实质是核外电子排布呈周期性变化的必然结果,答案选C。
点评:该题是识记性知识的检验,侧重对基础知识的巩固,难度不大,记住并能灵活运用即可。有利于巩固基础,提高学生应试能力。
本题难度:一般
3、填空题 甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第________族;丙元素的名称为________。
(2)甲的单质与水反应的离子方程式为____________________________;
乙单质与丙单质反应的化学方程式为______________________________。
参考答案:(1)四 ⅥA 锂
(2)2K+2H2O=2K++2OH-+H2↑? 4Li+O2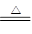 2Li2O
2Li2O
本题解析:甲的原子序数是19,甲是钾元素,乙是氧元素,丙是锂元素。
本题难度:一般
4、选择题 X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由强到弱的顺序是: Z> Y>X
B.Y元素最高价氧化物对应水化物的化学式可表示为H4YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为 Z >Y>X
参考答案:D
本题解析:根据元素的电子层结构可知,X是S,Y是O,Z是N,或者X是C,Y是Si,Z是Al。A、B、C不正确,所以只有选项D是正确的,答案选D。
本题难度:简单
5、选择题 下列比较关系与排列顺序错误的是(?)
A.酸性 H4SiO4<H3PO4<H2SO4<HClO4
B.碱性 Ca(OH)2>Mg(OH)2>Al(OH)3
C.稳定性SiH4>NH3>H2O>HF
D.半径 O2->F->Mg2+>Al3+
参考答案:C
本题解析:非金属性越强,最高价氧化物的水化物的酸性越强,相应氢化物的稳定性越强,所以A正确,C不正确,同样金属性越强,最高价氧化物的水化物的碱性越强,所以B正确。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,D正确。答案选C。
本题难度:简单