微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应。小组同学改进了下图所示的装置进行实验制取SO2的反应。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。试回答下列问题:
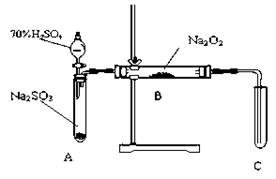
(3)? 请你完成装置改进的措施和理由:
请你完成装置改进的措施和理由:
 ①措施:在A、B之间加一个干燥管,
①措施:在A、B之间加一个干燥管, 作用_______________________________________。
作用_______________________________________。
 ②措施:为确保C中的实验现象发生,在B、C之间加一个装有_________________的洗气瓶,
②措施:为确保C中的实验现象发生,在B、C之间加一个装有_________________的洗气瓶, 作用_______________________。
作用_______________________。
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是____________________________。
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3 mol·L-1HCl、6 mol·L-1HNO3、NaOH稀溶液、蒸馏水、1 mol·L-1 BaCl2溶液、澄清石灰水、品红溶液。
①?提出合理假设:
假设1:白色固体为Na2SO3;?假设2: ? ;
假设3:白色固体为Na2SO3与Na2SO4的混合物。
②?设计实验方案证明以上三种假设,并按下表格式写出实验操作步骤、预期现象与结论。
实验操作
| 预期现象与结论
|
步骤1:取少量白色固体于试管,加入?,塞上单孔胶塞,将生成的气体通入?。
| 若?,说明白色固体含有Na2SO3,则?成立,若无该现象,
则?成立。
|
步骤2:在步骤1反应后的溶液加入?。
| 若?,则说明白色固体含Na2SO4。
结合步骤1的结论,则?成立,若无该现象,则?则?成立。
参考答案:(1)?①产生的二氧化硫没有干燥,水蒸气会与Na2O2反应;
②NaOH溶液?除去SO2气体,防止污染空气
(2) 2Na2O2+2SO2=2Na2SO3+O2(2分)
(3)①提出合理假设
假设3:白色固体为Na2SO4
②
实验操作
预期现象与结论
步骤1:取少量白色固体于试管,加入过量3 mol·L-1的稀盐酸,塞上单孔胶塞,将生成的气体通入品红溶液。
若有能使品红溶液褪色的无色气体生成,说明白色固体含有Na2SO3。则假设1或3成立,若无该现象,则假设2成立。
步骤2:在步骤1反应后的溶液加入1 mol·L-1 BaCl2溶液。
若有白色沉淀生成,则说明白色固体含Na2SO4。结合步骤1的结论,则假设3成立,若无该现象,则假设1成立。
本题解析:(1)2Na2O2+2H2O=4NaOH+O2↑?二氧化硫是有毒气体,实验中要除去以防污染空气。(2)由CO2与Na2O2的反应,生成了Na2SO3和O2,化学方程式为2Na2O2+2SO2═2Na2SO3+O2。(3)要证明白色固体中含有Na2SO3只需检验出含有SO32-就可以了,取少量白色固体,加入稀硫酸或稀盐酸,产生能使品红溶液褪色的气体,则证明生成的白色固体中含有Na2SO3。2O2性质,物质的检验
点评:本题为研究性试题,以探究过氧化钠与二氧化硫的反应为依托,考查知识的迁移能力、设计和评价实验方案的能力
本题难度:一般
2、填空题 (11分)I.“阿波罗登月计划”总指挥韦伯在“阿波罗”登月成功后曾说:“阿波罗计划”中没有一项新发明的技术,都是现成的技术,关键在于综合。综合也是创新,例如可以用玻璃管制成的U形管、T形管、乳胶管、弹簧夹连接成如图所示的一种装置,在U型管中加入适量的红色溶液,即得简单U型气压计,我们可将它应用于多项实验,如:
A.证明空气中的氧气参与氧化还原反应的实验(如铁生锈);
B.溶解热效应实验(如硝酸铵溶于水);
C.装置的气密性检验实验;
D.检验某些气体性质的实验(如CO2,SO2、Cl2等与碱溶液的反应)等等。
|
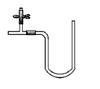 ?
?
请从A或B中选择一项实验,画出该实验的装置图,写出实验名称。要求:①除U形气压计外,其他实验仪器或用品仅能从以下仪器中选取: 广口瓶、小试管、胶头滴管、橡皮塞、乳胶管、导管;②实验药品或试剂自定,但需在图中注明。
广口瓶、小试管、胶头滴管、橡皮塞、乳胶管、导管;②实验药品或试剂自定,但需在图中注明。

实验名称:?
Ⅱ .广口瓶简单,但它的用途真不简单!实验室用Zn粒和盐酸反应制得的H2,其中含酸雾、水汽、硫化氢及少量氧气等杂质气体,某同学仅用四只广口瓶设计了以下几种装置,按一定顺序连接,便达到了当气体通过时,每一装置除去一种气体的目的。
.广口瓶简单,但它的用途真不简单!实验室用Zn粒和盐酸反应制得的H2,其中含酸雾、水汽、硫化氢及少量氧气等杂质气体,某同学仅用四只广口瓶设计了以下几种装置,按一定顺序连接,便达到了当气体通过时,每一装置除去一种气体的目的。
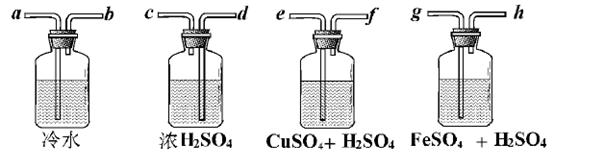
(1)它们连接的顺序为________________________________;
(2)除去H2S的离子方程式为________________;
(3)除去O 2的离子方程式为________________,观察到的现象为________________。
2的离子方程式为________________,观察到的现象为________________。
参考答案:(11分)Ⅰ、(4分,画图3分,实验名称1分)
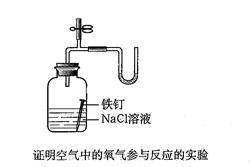
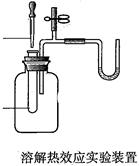
NH4NO3固体
(此装置只需画出其一即可,其他合理答案酌情给分)
Ⅱ、(最后一空1分,其余每空2分)
(1)a→b→e→f→g→h→d→c
(2) Cu2++H2S=CuS↓+2H+
Cu2++H2S=CuS↓+2H+
(3)4Fe2++O2+4H+=4Fe3++2H2O
现象:装有FeSO4和H2SO4溶液的广口瓶中溶液的颜色由浅绿色变成棕黄色
本题解析:略
本题难度:一般
3、实验题 “阳光”牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水。某校化学兴趣小组欲探究该“脱氧剂”中Fe粉和活性炭质量之比,设计并进行了如下探究过程,请你参与实验并回答下列有关问题。
(1)取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”的铁已部分被_____________。
(2)将(1)中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是______________________;将滤渣分为两等份,每一份质量为8.0g将其中一份在氧气流中充分灼烧,生成的气体全部通入足量澄清石灰水,得到干燥、纯净的沉淀20.0g。8.0g滤渣中活性炭的质量为____________________。将另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。滤出不溶物。向滤液中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
(3)结论:该“脱氧荆”中的Fe粉和活性炭质量之比约为_____________________。
参考答案:(1)氧化
(2)除去氧化钠;2.4g
(3)2:1
本题解析:
本题难度:一般
4、实验题 (18分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ称取1.500 g样品,加水溶解,配成250 mL溶液。
步骤Ⅱ用酸式滴定管量取25.00 mL样品溶液于 250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。?
250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。?
⑴根据实验步骤填空:
①步骤Ⅰ中用到的主要玻璃仪器有?;
②步骤Ⅱ中酸式滴定管用蒸馏水洗涤后,直接加入样品溶液进行量取,则测得样品中氮质量分数?(填“偏高”、“偏低”或“无影响”,下同)。锥形瓶用蒸馏水洗涤后,水未倒尽,则对滴定时用去NaOH标准溶液的体积?。滴定时对NaOH标准溶液体积,读取初读数时仰视,读取终读数时姿势正确,则测得样品中氮质量分数?。
③滴定时边滴边摇动锥形瓶,眼睛应观察?
A.滴定管内液面的变化?
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由?色变成?色。
⑵滴定结果如表所示:
滴定次数
| 待测溶液体积/ml
| 标准NaOH溶液体积读数(ml)
|
滴定前/ml
| 滴定后/ml
|
1
| 25.00
| 1.02
| 21.03
|
2
| 25.00
| 2.00
| 21.99
|
3
| 25.00
| 2.30
| 22.30
|
则消耗NaOH标准溶液的体积平均为?,该样品中氮的质量分数为?。
参考答案:(18分)
⑴①250 mL容量瓶、胶头滴管、烧杯、玻璃棒(2分)?②偏低(2分)?无影响?(2分)偏低?(2分)③B?(2分)④无?(2分)?粉红?(2分)
⑵20.00?(2分) 18.85%?(2分)
本题解析:略
本题难度:一般
5、填空题 某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验方案
| 实验现象
|
①将氯水滴加到溴化钠溶液中,振荡后加入适量CCl4溶液,振荡,静置
| A.浮在水面上,熔成小球,不定向移动,随之消失
|
②将一小块金属钠放入冷水中
| B.分层,上层无色,下层紫色
|
③将溴水滴加到NaI溶液中,振荡后,再加入适量CCl4,再振荡,静置
| C.浮在水面上,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失
|
④将一小块金属钾放入冷水中
| D.分层,上层无色,下层橙色
|
请你帮助该同学整理并完成实验报告。
(1)实验目的:_______________________________________。
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1 mol·L-1 NaBr溶液、0.1 mol·L-1 NaI溶液、CCl4等。
②仪器:________、________、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):
实验方案
| 实验现象
| 化学方程式
|
①
| ?
| ?
|
②
| ?
| ?
|
③
| ?
| ?
|
④
| ?
| ?
|
(4)实验结论:________________________________________________________________________。
(5)请用原子结构的知识简单解释上述实验结论________________________________________________。
参考答案:(1)探究同主族元素性质的相似性和递变性? (2)试管 胶头滴管
(3)
实验方案
实验现象
化学方程式
①
D
Cl2+2NaBr===2NaCl+Br2
②
A
2Na+2H2O===2NaOH+H2↑
③
B
Br2+2NaI===2NaBr+I2
④
C
2K+2H2O===2KOH+H2↑
(4)同主族元素性质相似;自上而下元素原子失电子能力增强,得电子能力减弱
(5)由于同主族元素原子最外层电子数相同,所以同主族元素性质相似。又由于随着原子序数的递增,原子半径逐渐增大, 原子核对最外层电子的吸引力减弱,所以元素原子得电子能力减弱,失电子能力增强
本题解析:该实验目的是探究同主族元素性质的相似性和递变性。由于主族元素原子最外层电子数相同,所以性质相似;而随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的吸引力减弱,元素原子得电子能力减弱,失电子能力增强,所以同主族因素自上而下金属性逐渐增强,非金属性逐渐减弱,据此可以进行验证和探究。
点评:该题是基础性试题的考查,也是高考中的常见题型和考点。试题贴近高考,基础性强,难易适中,注重对学生能力的培养和基础知识的训练,主要是考查学生灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性。该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般