微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某校研究性学习小组同学在实验时把一定量的SO2通入装有一定浓度BaCl2溶液的试管中,出现了白色浑浊物。
⑴实验小组的同学查阅了工具书上的相关数据,经过计算推导得出:即使把SO2通入BaCl2溶液中至饱和,也不可能生成BaSO3,故白色浑浊物只能是BaSO4。你认为所查阅的数据为:
SO2的溶解度、SO2饱和溶液中各离子的浓度以及_______________。
⑵小组同学对白色浑浊物成分及产生原因进行了各种合理的假设,并分别设计实验验证假设如下:

请把上表填充完全。
⑶写出在验证假设2的实验时,溶液中发生的反应的化学方程式:________________、
_______________;
⑷请你再提供一种假设。白色浑浊物是BaSO4,造成原因是________________。
参考答案:⑴BaSO3的溶度积或BaSO3的溶解度?
⑵假设1:在白色浑浊物中加入过量盐酸,变澄清;假设2:BaCl2溶液中溶解的氧气把亚硫酸氧化成硫酸;假设3:SO2中混有空气,把亚硫酸氧化成硫酸
⑶2SO2 +O2 +2H2O = 2H2SO4或SO2 +H2O =H2SO3、2H2SO3 + O2=2H2SO4;H2SO4 + BaCl2=
BaSO4↓+2HCl?
⑷BaCl2溶液中混有Ba(NO)3、HNO3、H2O2、Fe3+等均可
本题解析:
本题难度:一般
2、实验题 试用实验室提供的下列试剂,设计两个原理不同的简单实验(只要写出两个实验方案即可),证明镁元素的金属性比铝强。试剂:Mg条、Al丝、AlCl3溶液、MgCl2溶液、稀HCl、NaOH溶液
实验方案:①__________________;
实验方案:②__________________。
参考答案:实验方案①:用Mg条和Al丝分别与盐酸反应,观察其反应速率的快慢
实验方案②:将Mg条和Al丝靠在一起,插入稀HCl中,观察其气泡产生的情况
本题解析:
本题难度:一般
3、实验题 (11分)过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验。
Ⅰ.调查
(1)通过查阅资料,发现过氧化氢的沸点为152.1℃,而相对分子质量相同的硫化氢的沸点为-60.4℃,造成两者沸点差异大的主要原因是?;
(2)?资料显示,过氧化氢制备目前最常用的是乙基蒽醌法,其主要过程可以用如图所示,写出此过程的总反应方程式是?。
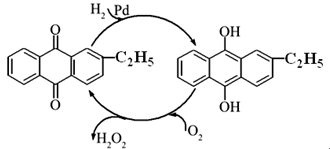
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
实验编号
| T/℃
| H2O2初始浓度/
mol·L-1
| FeCl3初始浓度/
mol·L-1
|
Ⅰ
| 20
| 1.0
| ?
|
Ⅱ
| 50
| 1.0
| 0
|
Ⅲ
| 50
| ?
| 0.1
|
①实验Ⅰ、Ⅱ研究温度对分解速率的影响,则实验Ⅰ中FeCl3初始浓度应为?mol·L-1,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为?mol·L-1。
②三组实验中分解速率最快的是?(填编号)。
Ⅲ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO4-+5H2O2+6H+?=2Mn2++8H2O+?5O2
(4)滴定到达终点的现象是__________________________________________________。
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的 KMnO4标准溶液体积如下表所示:
?
| 第一次
| 第二次
| 第三次
| 第四次
|
体积(mL)
| 17.10
| 18.10
| 18.00
| 17.90
|
计算试样中过氧化氢的浓度为?mol·L-1。
(6)若滴定前尖嘴中有气泡,滴定后消失,则测定结果??(“偏高”或“偏低”或“不变”)。
参考答案:⑴过氧化氢分子间可以形成分子间氢键,而H2S不能形成氢键(1分)
⑵?H2+O2 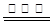 ?H2O2 (2分,写不写催化剂都给分)
?H2O2 (2分,写不写催化剂都给分)
⑶? 0(1分), 1.0(1分),Ⅲ(1分)
⑷锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色 (2分)
⑸0.1800 (2分)
⑹偏高(1分)
本题解析:略
本题难度:一般
4、填空题 工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:

(1)冷却过滤的目的??。
(2)通入反应器2的SO2作用是?;反应器2中发生反应的离子方程式为?。
(3)循环使用的物质是??。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是?。
(5)通过电解NaClO3水溶液的方法也可以制备NaClO4,进而可以制备HClO4,写出阳极的电极反应式??。
参考答案:(1)降低NaHSO4的溶解度并分离出NaHSO4晶体(2分)
(2)二氧化硫作为还原剂把ClO2还原为NaClO2、(2分)
2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;(4分)
(3)H2SO4(2分)
(4)高氯酸的沸点比较低,容易从溶液中逸出;(2分)
(5)阳极反应式? H2O+ClO3—-2e—= ClO4— + 2H+。(4分)
本题解析:略
本题难度:一般
5、实验题 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
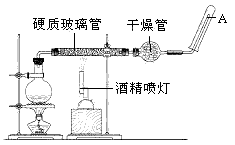
请回答该实验中的问题。
(1)写出该反应的反应方程式:________________ ;并指明该氧化还原反应的还原剂是_________ ,氧化剂是__________ ,假设有1mol氧化剂参加反应,转移的电子数的物质的量为____________ 。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是_____________ ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_______________ 。
(3)酒精灯和酒精喷灯点燃的顺序是 ,为什么?__________________ 。
(4)干燥管中盛装是的物质是_____________ ,作用是_______________ 。
(5)某次实验后,取硬质玻璃管中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。溶液颜色无明显变化,试解释原因 ___________________。
参考答案:(1)3Fe+4H2O(g)=== Fe3O4+4H2 ;Fe;H2O;2mol
(2)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;防止暴沸
(3)先点酒精灯,再点酒精喷灯;防止先点燃酒精喷灯所导致的Fe与O2的反应。
(4)碱石灰干燥剂;除去反应产生的H2中的水蒸气。
(5)过量的铁与生成的Fe3+反应生成Fe2+,故加入KSCN溶液后颜色无明显变化
本题解析:
本题难度:一般