微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
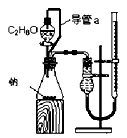
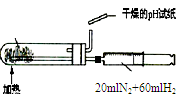
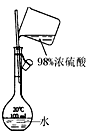
1、选择题 下列实验装置设计正确,且能达到目的的是
| 
| 
| 
|
A.测定乙醇分子结构
| B.合成氨并检验氨的生成并回收CCl4
| C.碘的CCl4溶液中分离I2
| D.配制稀硫酸溶液
|
?
参考答案:A
本题解析:A、装置中左边是反应装置,右边是量气装置,正确;B、应用湿润的红色石蕊试纸或pH试纸检验氨气,错误;C、蒸馏操作中应把温度计的水银球放在蒸馏烧瓶的支管口处测定出去气体的温度,错误;D、浓硫酸溶解放出大量热,不能直接在容量瓶中稀释,错误。
本题难度:一般
2、实验题 镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下
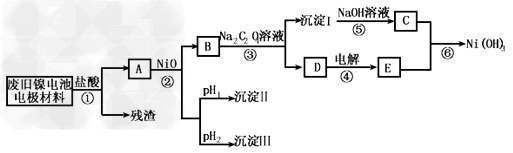
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+ ? ②某温度下一些金属氢氧化物的Kap及沉淀析出的理论pH如下表所示
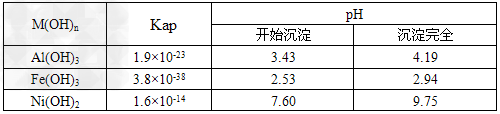
回答下列问题:
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ________和沉淀Ⅲ_________(填化学式),则pH1________pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用_____。
A.pH试纸 B.石蕊指示剂?C.pH计
(2)已知溶解度:NiC2O4·H2O>NiC2O4·2H2O,则③的化学方程式是______________。第③步反应后,过滤沉淀嘶需的玻璃仪器有_____________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因______________、______________?。
(3)④中阳极反应产生的气体E为____________,验证该气体的试剂为______________。
(4)试写出⑥的离子方程式_____________________。?
参考答案:(1)Fe(OH)3;Al(OH)3;<;C
(2)NiCl2 + Na2C2O4 + 2H2O = NiC2O4·2H2O↓ + 2NaCl;漏斗、玻璃棒、烧杯;玻璃棒划破滤纸;滤液超过滤纸边缘
(3)Cl2;淀粉碘化钾溶液
(4)2Ni(OH)2 + 2OH- + Cl2 = 2Ni(OH)3+ 2Cl-
本题解析:
本题难度:一般
3、选择题 实验中的下列操作正确的是(?)
A.取Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒回试剂瓶中。
B.将剩余的金属钠放回原盛放金属钠的试剂瓶中。
C.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部蒸干才停止加热。
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
参考答案:BD
本题解析:略
本题难度:简单
4、简答题 图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置.其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉.
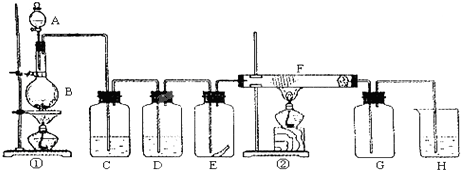
试回答:
(1)A试剂为______,B试剂为______,化学方程式为______;
(2)C试剂为______;D试剂作用为______;
(3)E中干燥红色布条______(填“褪色”或“不褪色”);
(4)F管中现象______;
(5)H中化学方程式为______.
参考答案:根据题中所给出的信息可知本实验是室制取纯净、干燥的Cl2,并进行检验Cl2性质实验.
(1)依据课本所学制备氯气用的是浓盐酸和固体MnO2的加热反应.所以A为浓盐酸,B为MnO2,反应的化学方程式为:MnO2+4HCl-?△?.?MnCl2+Cl2↑+2H2O,
故答案为:浓盐酸;MnO2;MnO2+4HCl-?△?.?MnCl2+Cl2↑+2H2O;
(2)由①中生成氯气,氯气通到C中出去挥发出的HCl气体,除去HCl气体有饱和食盐水,因此C为饱和食盐水;氯气从C中通入 到D中进行干燥出去氯气的水蒸气,D中是浓硫酸,
故答案为:饱和食盐水;吸水氯气中的水蒸气;
(3)氯气从D中出来后是干燥的氯气,通到E中,干燥的氯气不能漂白,因此E中的干燥布条不褪色,故答案为:不褪色;
(4)已知F中是铜网,在加热的条件下,氯气与Cu发生反应,生成棕黄色的烟.脱脂棉的作用是为了防止防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管,影响氯气的收集,
故答案为:棕黄色的烟;
(5)氯气是有毒气体,所以H中是吸收多余气体的NaOH溶液,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
本题解析:
本题难度:一般
5、选择题 下列根据实验操作和现象所得出的结论正确的是(?)
选项
| 实验操作
| 实验现象
| 结 论
|
A
| 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液
| 均有固体析出
| 蛋白质均发生变性
|
B
| 将少量某无色气体通入澄清石灰水
| 出现白色沉淀
| 该气体一定是CO2
|
C
| 分别用测定常温下0.1 mol·L--1 Na2SiO3和Na2CO3的PH
| PH:Na2SiO3﹥Na2CO3
| 非金属性Si﹥C
|
D
| 向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中,
滴加少量AgNO3溶液
| 出现黄色沉淀
| Ksp(AgCl)>Ksp(AgI)
|
?
参考答案:D
本题解析:A项前者为盐析,后者为变性;B项有可能为SO2气体;C项能得出碳酸的酸性比硅酸酸性强,则非金属性C>Si
点评:根据实验操作和现象推断化学性质,难度较大。涉及到常见反应的反应现象,需要模拟实验,结合实践经验,联想实验现象。
本题难度:简单