1、填空题 (9分)
下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答 下列问题:
下列问题:
①
| ?
| ?
|
?
| ?
| ?
| ?
| ②
| ③
| ④
| ⑤
| ?
|
⑥
| 来
| ⑦
| ?
| ?
| ⑧
| ⑨
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | |
|
(1)元素③形成的单质的电子式为?;元素②形成的最高价氧化物的结构式为?。
(2)②、③、④、⑤元素形成的氢化物中,热稳定性最强 的是?
的是? ?(填化学式),沸点最高的是?(填化学式)。
?(填化学式),沸点最高的是?(填化学式)。
(3)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较?>?(填化学式)。
(4)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为?。
(5)元素⑩在周期表中的位置?;
2、选择题 X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X表面有Z析出,X与Y组成原电池时,Y为负极。X、Y、Z三种金属的活动性顺序为(? )
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Y>Z>X
3、填空题 砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)砷的基态原子的电子排布式为?。
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主。Ga和As相比,电负性较大的是?,GaAs中Ga的化合价为?。
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为?;
AsH3的沸点高于PH3,其主要原因为?。
(4)Na3AsO4可作杀虫剂。AsO43-的立体构型为?,与其互为等电子体的分子的化学式为?(任写一种)。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因?。
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图。已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为______g/cm3(只要求列算式,不必计算)。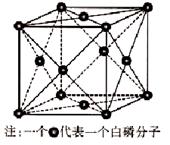
4、选择题 下列说法错误的是
A.化学可以识别、改变和创造分子
B.在化学反应中,反应前后电子总数可能发生变化
C.摩尔是一个单位,用于计量物质所含微观粒子的多少
D.在化学反应中,反应前后原子种类、原子数目和质量一定不变
5、选择题 原子序数依次相差1,且由小到大排列的A、B、C、D、E五种短周期元素。下列是有关这五种元素的叙述:?
①若A的最高价氧化物的水化物是强碱,则E的最高价氧化物的水化物是强酸
②若A的单质既能与强酸又能与强碱反应且都放出氢气,则这五种元素在同一周期
③若A的阳离子比E的阴离子少8个电子,则D一定是非金属元素
④若D的最高价氧化物的水化物是强酸,则E的单质在常温下为气态
⑤若B的单质是原子晶体,则B的氧化物是分子晶体
其中正确的是(?)A.①②③? B.②③④? C.③④⑤? D.②④⑤