1、填空题 (9分)
下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答 下列问题:
下列问题:
①
| ?
| ?
|
?
| ?
| ?
| ?
| ②
| ③
| ④
| ⑤
| ?
|
⑥
| 来
| ⑦
| ?
| ?
| ⑧
| ⑨
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | |
|
(1)元素③形成的单质的电子式为?;元素②形成的最高价氧化物的结构式为?。
(2)②、③、④、⑤元素形成的氢化物中,热稳定性最强 的是?
的是? ?(填化学式),沸点最高的是?(填化学式)。
?(填化学式),沸点最高的是?(填化学式)。
(3)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较?>?(填化学式)。
(4)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为?。
(5)元素⑩在周期表中的位置?;
参考答案:

本题解析:略
本题难度:一般
2、选择题 X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X表面有Z析出,X与Y组成原电池时,Y为负极。X、Y、Z三种金属的活动性顺序为(? )
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Y>Z>X
参考答案:C
本题解析:X表面有Z析出,X>Z。X与Y组成原电池时,Y为负极,活泼的做负极,Y>X,Y>X>Z
本题难度:一般
3、填空题 砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)砷的基态原子的电子排布式为?。
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主。Ga和As相比,电负性较大的是?,GaAs中Ga的化合价为?。
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为?;
AsH3的沸点高于PH3,其主要原因为?。
(4)Na3AsO4可作杀虫剂。AsO43-的立体构型为?,与其互为等电子体的分子的化学式为?(任写一种)。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因?。
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图。已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为______g/cm3(只要求列算式,不必计算)。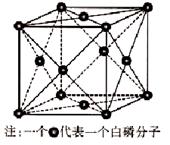
参考答案:
(1)1s22s22p63s23p63d104s24p3?(2分)
(2) As? (1分)? +3 (1分)
(3)sp3杂化(1分)
AsH3的相对分子质量比PH3的大,分子间作用力大,因而AsH3的沸点比PH3高。(2分,相对分子质量大和分子间作用力大两个给分点各1分。)
(4)正四面体(2分) ?CF4? SiF4?CCl4? SiCl4等(2分)
(5)H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中的As为+5价,正电性更高,导致As-O-H中的O的电子更向As偏移,越易电离出H+。(2分)
(6)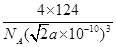 或?
或?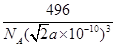 ?(2分,其他合理答案也可给分)
?(2分,其他合理答案也可给分)
本题解析:(1)As是33号元素,基态原子核外电子排布为1s22s22p63s23p63d104s24p3。
(2)As、Ga在同一周期,同周期元素电负性自左向右逐渐增大,As在Ga的右面,As的电负性大。As的负化合价为-3,因此Ga的化合价为+3。
(3)AsH3与NH3结构相似,因此AsH3中As的杂化方式为sp3。AsH3、PH3属于分子晶体,相对分子质量越大,熔、沸点越高。
(4)根据ABn型分子构型判断方法,AsO43-的电子对有(5+3)/2=4对,中心原子sp3杂化,因此空间构型为正四面体构型。
5核32电子的分子有CF4? SiF4?CCl4? SiCl4等。
(5)酸性强弱主要看是否容易电离出H+,因此分析出H3AsO4易电离出H+的原因即可。
(6)每一个晶胞中含有的白磷分子数为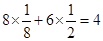 个,晶胞的棱长为
个,晶胞的棱长为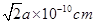 ,每个晶胞的质量为
,每个晶胞的质量为 ,因此晶胞的密度为
,因此晶胞的密度为 。
。
本题难度:困难
4、选择题 下列说法错误的是
A.化学可以识别、改变和创造分子
B.在化学反应中,反应前后电子总数可能发生变化
C.摩尔是一个单位,用于计量物质所含微观粒子的多少
D.在化学反应中,反应前后原子种类、原子数目和质量一定不变
参考答案:B
本题解析:A、分子是保持物质化学性质的微粒,因此在化学变化中分子是可以再分的,所以化学可以识别、改变和创造分子,A正确;B、在化学反应中,反应前后电子总数必须是守恒的,不可能发生变化,B不正确;C、摩尔是物质的量的单位,用于计量物质所含微观粒子的多少,C正确;D、原子是化学变化中的最小微粒,所以在化学反应中,反应前后原子种类、原子数目和质量一定不变,即一定满足质量守恒定律,D正确,答案选B。
本题难度:简单
5、选择题 原子序数依次相差1,且由小到大排列的A、B、C、D、E五种短周期元素。下列是有关这五种元素的叙述:?
①若A的最高价氧化物的水化物是强碱,则E的最高价氧化物的水化物是强酸
②若A的单质既能与强酸又能与强碱反应且都放出氢气,则这五种元素在同一周期
③若A的阳离子比E的阴离子少8个电子,则D一定是非金属元素
④若D的最高价氧化物的水化物是强酸,则E的单质在常温下为气态
⑤若B的单质是原子晶体,则B的氧化物是分子晶体
其中正确的是(?)A.①②③? B.②③④? C.③④⑤? D.②④⑤
参考答案:B
本题解析:①不正确,例如A是Na,则E是P。⑤不正确,例如硅是原子晶体,二氧化硅也是原子晶体。其余都是正确的,答案选B。
本题难度:简单