1、填空题 三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式:?。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是?。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为?。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是?,配位数为?。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
元素代号
| I1
| I2
| I3
| I4
|
Q
| 2080
| 4000
| 6100
| 9400
|
R
| 500
| 4600
| 6900
| 9500
|
S
| 740
| 1500
| 7700
| 10500
|
T
| 580
| 1800
| 2700
| 11600
|
U
| 420
| 3100
| 4400
| 5900
|
?
①在周期表中,最可能处于同一族的是?和?。
②T元素最可能是??(填“s”“P” “d”或“ds”等)区元素,位于?族。若T为第2周期元素,F是第3周期元素中原子半径最小的元素,则T与F形成化合物的空间构型为?,其中心原子的杂化方式为?。
2、填空题 (14分)下列是元素周期表的二、三、四周期中的部分元素
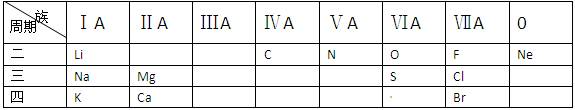
(1)表中所标出的元素当中,最活泼的金属元素是________,最活泼的非金属元素是________,最不活泼的元素是________;
(2)C与N相比,原子半径 较小的是??;
较小的是??;
(3)K和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为:KOH?Mg(OH)2 (大于/小 于);
于);
(4)已知①2H2+O2 2H2O;②Cl2和H2混合,在光照下就可以发生爆炸,生成HCl。据此推断,活泼性比较:O2?Cl2 (大于/小于);
2H2O;②Cl2和H2混合,在光照下就可以发生爆炸,生成HCl。据此推断,活泼性比较:O2?Cl2 (大于/小于);
另由③Cl2+2NaBr=Br2+2NaCl,可推断氧化性比较:Cl2 ?Br2 (大于/小于)。
3、选择题 某元素原子的原子核外有三个电子层,最外层电子数是4,该原子核内的质子数是(?)
A.14
B.15
C.16
D.17
4、选择题 下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是
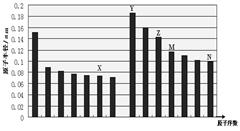
A.非金属性:X>N
B.气态氢化物的稳定性:M<N
C.X和Y形成的化合物中只可能含离子键
D.化合物MX2能与碱反应,不能与任何酸反应
5、选择题 下列各物质或微粒性质的比较中正确的是
A.沸点:H2O>H2S>H2Se
B.热稳定性:H2CO3>NaHCO3>Na2CO3
C.半径:Cl<Cl-<S2-
D.酸性:H2CO3<HNO3<H3PO4