1、实验题 试用实验室提供的下列试剂,设计两个原理不同的简单实验(只要写出两个实验方案即可),证明镁元素的金属性比铝强。试剂:Mg条、Al丝、AlCl3溶液、MgCl2溶液、稀HCl、NaOH溶液
实验方案:①__________________;
实验方案:②__________________。
参考答案:实验方案①:用Mg条和Al丝分别与盐酸反应,观察其反应速率的快慢
实验方案②:将Mg条和Al丝靠在一起,插入稀HCl中,观察其气泡产生的情况
本题解析:
本题难度:一般
2、简答题 髙纯氧化铁(a-Fe2O3)是现代电子工业重要材料.实验室用硫铁矿烧渣(Fe2O3、FeO、SiO2等)为原料制备髙纯氧化铁的步骤如图所示.请回答有关问题:
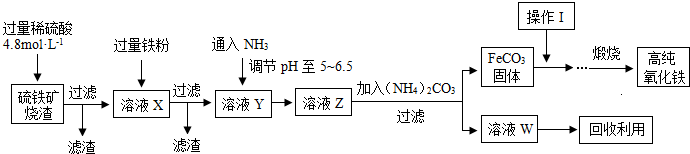
(1)过滤操作中的玻璃仪器为______.
(2)实验室需240mL4.8mol?L-1的硫酸溶液,若用18.4mol?L-1的浓硫酸进行配制,所需要的最主要仪器为______.
(3)溶液X发生反应的离子方程式为______.
(4)简述如何检验溶液Z中的阴离子______.
(5)操作I的名称是______.列举W的一种用途______.
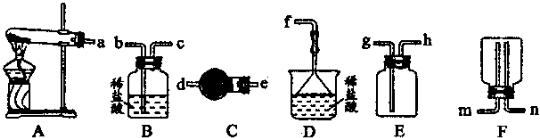
(6)某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理.选择合适的仪器,按照气体流向排序(如图所示大写字母表示)______.
(7)将多余的氨气通入水中,若得到25℃0.2mol?L-1的NH3?H2O溶液,现提供0.1 mol?L-1盐酸溶液,请你设计实验,证明NH3?H2O的电离程度大于NH4Cl的水解程度.简述实验方案及结论______.
参考答案:(1)过滤时要注意一贴、二低、三靠.一贴是指滤纸紧贴漏斗内壁.二低是指滤纸低于漏斗边缘,液面低于滤纸边缘.三靠是指上面的烧杯紧靠玻璃棒,所以实验过程中用到的三种玻璃仪器是漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒;
(2)配制一定物质的量浓度溶液必须用到容量瓶,容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,所以240mL4.8mol?L-1的硫酸溶液所需要的最主要仪器为250mL容量瓶,
故答案为:250mL容量瓶;
(3)硫铁矿烧渣(Fe2O3、FeO、SiO2等)加入硫酸,酸会和Fe2O3、FeO反应,生成Fe2+、Fe3+,而与SiO2不反应,过滤得到溶液X的主要离子成分为SO42-、H+、Fe2+、Fe3+,加过量铁粉,铁粉和H+、Fe3+反应,2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑,
故答案为:2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑;
(4)过量铁粉和H+、Fe3+反应后过滤,溶液中主要离子成分为Fe2+、通入氨气,调节PH至5-6.5,生成氢氧化铁沉淀,此时溶液中主要离子成分为SO42-、NH4+,所以需检验溶液Z中的阴离子SO42-,检验SO42-的操作为取少量溶液Z于试管中,然后加盐酸,无沉淀产生,再加氯化钡溶液,有白色沉淀产生,证明有SO42-,
故答案为:检验SO42-的操作为:取少量溶液Z于试管中,然后加盐酸,无沉淀产生,再加氯化钡溶液,有白色沉淀产生,证明有SO42-;
(5)固体从溶液中出来表面吸附有溶液中的可溶性的杂质离子,需通过洗涤洗去;溶液Z加碳酸铵生成硫酸亚铁和硫酸氨,所以W为硫酸铵,可作化肥,
故答案为:洗涤;化肥;
(6)实验室用氯化铵和氢氧化钙固体加热生成氨气和水来制取氨气,故选A装置,生成的氨气中含有水蒸气,所以用球形干燥管进行干燥选C,氨气极易溶于水密度小于空气的平均密度,所以选E用排空气法收集从h口进,氨气具有刺激性,氨气是有毒气体,需进行尾气吸收选D,
故答案为:ACED;
(7)铵根离子水解溶液呈酸性,氨水电离呈碱性,25℃0.2mol.L-1的NH3?H2O溶液和0.1mol.L-1盐酸溶液等体积混合,生成等物质的量浓度的氨水和氯化铵,测溶液的PH值大于7,说明铵根离子的水解能力小于氨水的电离能力,
故答案为:将25℃0.2mol.L-1的NH3?H2O溶液和0.1mol.L-1盐酸溶液等体积混合,测溶液的PH值,PH大于7,证明NH3?H2O的电离程度大于NH4Cl的水解程度;
本题解析:
本题难度:一般
3、实验题 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如下图所示的装置。

请回答下列问题。
(1)铜和浓硫酸反应的化学方程式为____________________。
(2)B瓶中盛有品红溶液,观察到品红溶液褪色,这是因为SO2具有___________(填选项的字母,下同),C瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有___________。
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有NaOH溶液,作用是___________,该反应的离子方程式为______________________。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入__________(填选项的字母)。
A.HNO3 B.NaNO3 C.NaHCO3 D.Na2CO3
参考答案:(1)Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
(2)C;B
(3)吸收剩余的SO2,防止造成空气污染;SO2+2OH- =SO32-+H2O
(4)AB
本题解析:
本题难度:一般
4、实验题 在常温下,Fe与水并不起反应,但在高温下,红热的铁能与水蒸气反应,有氢气生成,现用下图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题
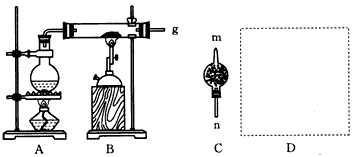
(1)写出铁在高温下与水蒸气反应的化学方程式:________________________。
(2)干燥管C内盛放的药品是____或____。干燥管的____(填“m”或“n”)端与g导管相连接。
(3)在D处画出用简单方法(用试管)来收集氢气的装置图(所需其他仪器自己选择)。
(4)圆底烧瓶中盛装的是水,该装置受热后的主要作用是_________________。
(5)怎样用简单的方法检验收集到的气体是氢气,简述实验操作步骤和现象________________。
参考答案:(1)3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(2)CaCl2;碱石灰(或CaO,答案合理均可);n? (3) (4)为硬质玻璃管内Fe与水蒸气的反应提供持续不断的水蒸气
(4)为硬质玻璃管内Fe与水蒸气的反应提供持续不断的水蒸气
(5)将收集到的气体验纯后点燃,火焰呈淡蓝色,在火焰上方罩一干冷烧杯,烧杯内壁有小液滴出现,证明收集到的气体是氢气
本题解析:
本题难度:一般
5、填空题 某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与少量的NaOH溶液反应的化学方程式:?(2分)
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中每转移2.5mol的电子则参加反应的还原剂的物质的量为?mol.(2分)
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl 、OH
、OH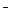 和SO
和SO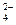 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设 .
假设1:只存在SO32-;?假设2:只存在ClO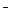
假设3:既不存在SO32-也不存在ClO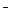 ;
;
假设4:?.(2分)
②设计实验方案进行实验。请在答题卡上写出实验步骤以及预期现象和结论
限选实验试剂:3moL L-1H2SO4、0.01mol
L-1H2SO4、0.01mol L-1KMnO4、紫色石蕊试液.(每空2分)
L-1KMnO4、紫色石蕊试液.(每空2分)
实验步骤
| 预期现象和结论
|
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中.
| ?
|
步骤2:
| ?
|
步骤3:
| ?
|
?
参考答案:(1) SO2+NaOH=NaHSO3(2分);? (2)1.25mol(2分)
(3) ①SO32-、ClO-都存在(2分)
②(每空2分)
实验步骤
预期现象和结论
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中
L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中
?
步骤2:在A试管中滴加紫色石蕊试液
若先变红后褪色,证明有ClO-,否则无
步骤3:在B试管中滴加0.01mol L-1KMnO4溶液
L-1KMnO4溶液
若紫红色退去,证明有SO32-,否则无
本题解析:略
本题难度:一般