1、实验题 (1)用简单的实验证明在氨水中存在NH3·H2O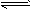 NH4++OH-的电离平衡(要求写出简单操作、现象及实验能说明的问题)。 _________________________________。
NH4++OH-的电离平衡(要求写出简单操作、现象及实验能说明的问题)。 _________________________________。
(2)老师给某学生提供下列药品和必要的实验仪器,要求学生设计实验证明醋酸是弱酸。药品为冰醋酸、蒸馏水和pH试纸。此同学思考后认为:
①设计的理论依据是_______________________________________;
②实验的简要步骤是_______________________________________;
③需记录的现象和数据是__________________________________;
④推断与分析:由于___________________________,说明________________,所以醋酸是弱酸。
2、实验题 (共17分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加?,该过程的现象为:?。
(2)步骤②加入过量H2O2的目的:?。
(3)步骤③中反应的离子方程式:?。
(4)步骤④中一系列处理的操作步骤:过滤、?、灼烧、?、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量?g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需?。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是?。
a.稀硝酸? b.稀硫酸? c.稀盐酸? d.浓硝酸
③滴定到终点时的现象描述为? ________________
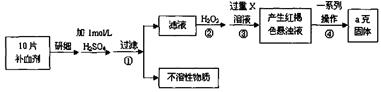
3、实验题 (20分)某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:

(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、?、?、
?等(只需答出三种仪器即可);
(2)操作④的试管加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣可能为MnO2,试管中发生反应的化学方程式:?;
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为:?。
(4)已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(O H)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
H)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
[猜想I]:主要成分为氯化铵;
[验证(操作)过程]:取少量滤液加入NaOH固体,并加热;
[实验现象]:闻到有轻微的氨味;
[判断猜想]:?(填“猜想I成立”或“猜想I不成立”);
[猜想II]:主要成分为氯化锌;
[验证(操作)过程]:?;
[实验现象]:?;
[判断猜想]:猜想Ⅱ成立;由上述实验得出结论:
操作②的滤液中的主要成分为:?;次要成分为:?。
4、实验题 为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
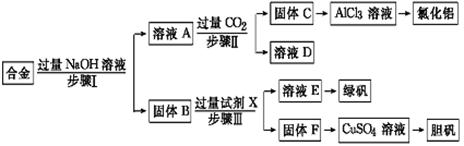
请回答:
(1)写出步骤Ⅰ反应的离子方程式:?。
(2)试剂X是?。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是?。
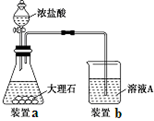
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是?。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式?,请选出你认为的最佳途径并说明选择的理由?。
5、填空题 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
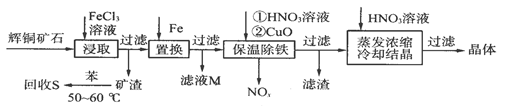
⑴写出浸取过程中Cu2S溶解的离子方程式:____________________。
⑵回收S过程中温度控制在50~60℃之间,不宜过高或过低的原因是_____________。
⑶气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为___________________________;向滤液M中加入(或通入)下列__________(填字母)物质,得到另一种可循环利用的物质。
a.铁? b.氯气? c.高锰酸钾?
⑷保温除铁过程中,加入CuO的目的是________________________;蒸发浓缩时,要用HNO3溶液调节溶液的pH,其理由是___________________________。