1、选择题 碱石灰和五氧化二磷均能干燥的一组气体是
A.N2、O2、NH3
B.CO、NO、H2
C.H2、NO、NH3
D.NO、Cl2、N2
参考答案:B
本题解析:P2O5是一种酸性氧化物,不能用于干燥碱性气体,又因其稳定性很好,是一种氧化能力很弱的物质,所以可用于干燥NO等还原性气体.碱石灰不能用于干燥酸性气体或跟水反应呈酸性的气体,如CO2、Cl2、NO2等.故答案为B项.
本题难度:简单
2、实验题 (6分)图5是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
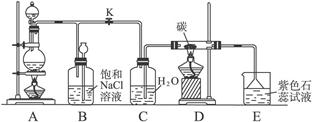
图5
(1)A为氯气发生装置,写出反应的化学方程式:_________________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯,连上E装置。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),试写出D装置中反应的化学方程式_______________________;装置C的作用是_________________________________。
(3)E处石蕊试液的现象是_____________________________________________________,其原因是______________________________________________________________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_________________________________。
a.有白色沉淀生成
b.无白色沉淀生成
c.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是________________________,B的作用是
___________________________。
参考答案:(1)MnO2+4HCl(浓)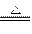 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)2Cl2+C+2H2O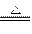 4HCl+CO2?提供D处所需的水蒸气
4HCl+CO2?提供D处所需的水蒸气
(3)石蕊试液先变红色,后变无色?生成的HCl使石蕊试液变红,未反应完的Cl2与H2O作用产生HClO,HClO的漂白作用使红色消失?
(4)b
(5)B瓶中液面下降,同时长颈漏斗内液面上升?贮存少量Cl2,避免Cl2对环境的污染
本题解析:实验室中制取Cl2常用MnO2与浓盐酸在加热条件下反应,反应原理:MnO2+4HCl(浓)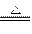 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)从生成物CO2和HCl(g)可以推理H2O与Cl2、C同时参与反应,其反应方程式为:2Cl2+C+2H2O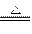 4HCl+CO2。装置C的作用是提供D处所需的水蒸气。
4HCl+CO2。装置C的作用是提供D处所需的水蒸气。
(3)石蕊试液先变红色,后变无色;生成的HCl使石蕊试液变红。未反应完的Cl2与H2O作用产生HClO,HClO的漂白作用使红色消失。
(4)从(2)反应不难分析,CO2和HCl同时作用于石灰水,且HCl与CO2的体积比为4∶1,显然盐酸过量,不能生成CaCO3沉淀。故答案为b。
(5)少量Cl2进入B瓶,由于瓶内压强增大, B瓶中液面下降,同时长颈漏斗内液面上升;B的作用是贮存少量Cl2,避免Cl2对环境的污染。
本题难度:简单
3、实验题 (11分)某同学按下列步骤配制500 mL 0.2 mol·L-1 KCl溶液,请回答下列问题:
实验步骤
| 有关问题
|
(1)计算所需KCl的质量
| 需要KCl的质量为______g
|
(2)称量KCl固体
| 称量过程中主要用到的仪器有________________
|
(3)将KCl放入到100 mL烧杯中加水溶解
| 为加快溶解速度,可采取的措施是______________________
|
(4)将烧杯中的溶液转移至500 mL容量瓶中
| 为防止溶液溅出,应采取的措施是____________________
|
(5)向容量瓶中加蒸馏水到刻度线
| 在进行此操作时应注意的问题是__________________________
|
你认为按上述步骤配制的KCl溶液的浓度是否为0.2 mol·L-1,请说明理由。
参考答案:
实验步骤
有关问题
(1)
7.45
(2)
天平、药匙
(3)
称前研细,溶解时搅拌或加热
(4)
玻璃棒引流
(5)
用玻璃棒引流,加入蒸馏水至离刻度线1~2_cm处,改用胶头滴管滴加至刻度线
本题解析:根据配制一定物质的量浓度溶液的步骤:
(1)n(KCl)=0.5 L×0.2 mol·L-1=0.1 mol
m(KCl)=74.5 g·mol-1×0.1 mol=7.45 g
(2)称KCl固体质量,所用仪器:天平、药匙。
(3)为加快溶解,可称前研细,溶解时搅拌或加热。
(4)为了防止移液时液体溅出,可采用玻璃棒引流。
(5)加蒸馏水时,用玻璃棒引流,加入蒸馏水至离刻度线1~2 cm处,改用胶头滴管滴加至刻度线。由于移液时未洗涤烧杯和玻璃棒,配制溶液的浓度低于0.2 mol·L-1。
本题难度:一般
4、实验题 (2分)下列实验操作或对实验事实的描述中正确的说法有?。
①如果苯酚浓溶液沾到皮肤上,应立即用酒精洗涤
②除去甲烷中混有的少量乙烯,可以让混合物通过盛有酸性KMnO4溶液的洗气装置
③实验室制硝基苯:向浓硝酸、浓硫酸的混合酸中滴入苯,在50~60℃的水浴中加热
④实验室制取乙烯时,将无水乙醇和10mol·L-1 H2SO4混合加热到1700C,可制得乙烯
⑤只用溴水就可将苯、四氯化碳、乙醇、己烯四种液体区别开来
⑥检验卤代烃中的卤离子,是将试样放入试管,然后加入NaOH煮沸,随即加入硝酸银即可。
参考答案:(2分)①③⑤
本题解析:②错,除去甲烷中混有的少量乙烯,可以让混合物通过盛有溴水溶液的洗气装置
④错,实验室制取乙烯时,将无水乙醇和18.4mol·L-1 H2SO4混合加热到1700C,可制得乙烯
⑥错,检验卤代烃中的卤离子,是将试样放入试管,然后加入NaOH煮沸,再加入过量的稀硝酸西化,随即加入硝酸银即可。
本题难度:一般
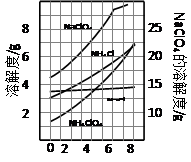
5、填空题 高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如图),其实验流程如下:
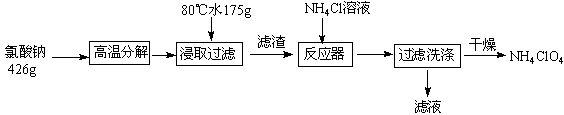
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为?。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为?(写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为?。
(4)已知:2NH4ClO4  N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
a.饱和食盐水? b.浓H2SO4? c.NaOH溶液? d.Mg? e.Cu? f.Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分步吸收或收集。

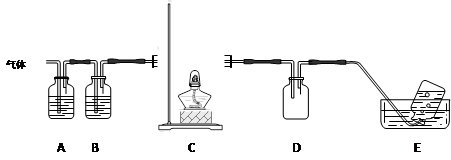
①E中收集到的气体可能是?(填化学式) 。
②装置D的作用可能是?。
③A、B、C中盛放的药品依次可以是?(选填:Ⅰ、Ⅱ、Ⅲ)。
Ⅰ. a b d?Ⅱ. c b e?Ⅲ. b c f
参考答案:
(1)4NaClO3=3NaClO4+NaCl?
(2)NaClO4 ;
?(3)NH4++ClO4-=NH4ClO4?;?
(4)①氮气;②安全瓶?③Ⅱ
本题解析:(1)根据氧化还原反应原理和信息,方程式为 ;(2)由图可知,NH4ClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大。(3)
;(2)由图可知,NH4ClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大。(3)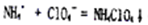 (4)A、B、C中盛放的药品依次可以是? c.NaOHb.浓H2SO4 e.Cu ①E中收集到的气体只能是氮气了。②装置D的作用以防水倒吸,所以起到安全瓶的作用;
(4)A、B、C中盛放的药品依次可以是? c.NaOHb.浓H2SO4 e.Cu ①E中收集到的气体只能是氮气了。②装置D的作用以防水倒吸,所以起到安全瓶的作用;
本题难度:一般