1、选择题 氢核聚变能产生大量的能量,而高纯度铍(Be)是制造核聚变反应装置中最核心的部件之一的屏蔽包的主要材料。据中新网2009年2月6日报道,我国科学家己成功地掌握了获取高纯度铍的技术。下列有关说法错误的是
A.10Be、9Be、8Be核内质子数均是4
B.Be元素在元素周期表的p区
C.氢核聚变后会产生新元素
D.从矿物中提取单质铍的过程中铍一定被还原
参考答案:B
本题解析:10Be、9Be、8Be互为同位素,核内质子数均是4,A正确;Be元素在元素周期表的s区,B不正确;核裂变会产生新的元素,C正确;铍是活泼的金属,金属冶炼一定是被还原的过程,D正确,答案选B。
点评:该题是常识性知识的考查,以新科技为载体,重点考查学生灵活运用基础知识解决实际问题的能力,有利于激发学生的学习兴趣和学习积极性。
本题难度:简单
2、推断题 A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C < B < E< D?
Ⅱ.原子的最外层电子数:A = D? C= E? A + B = C
Ⅲ.原子的核外电子层数:B =" C" = 2A?
Ⅳ.B元素的主要化合价:最高正价 + 最低负价 = 2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式?;
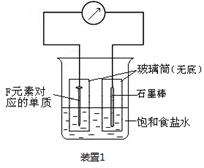
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式:?。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为?。单质F发生?(填电化学腐蚀类型)
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为?,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为?。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2。则该复
盐的化学式为?。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象?
?。
参考答案:(共14分)(1)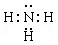 (1分)
(1分)
(2) Fe3O4+8H+=2Fe3++ Fe2++4H2O (2分);O2+2H2O+4e-=4OH- (2分) 吸氧腐蚀(1分)
(3) NH4NO2 + AgNO3=AgNO2↓+NH4NO3;c(NO2->c(NH4+)>c(H+)>c(OH-)(各2分)
(4)(NH4)2Fe(SO4)2、取少量该复盐于试管中并加水溶解,滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色,证明有Fe2+(或加氢氧化钠溶液,出现白色沉淀迅速变成灰绿色,最终变成红褐色。其他方案合理均可。)(各2分)
本题解析:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。根据原子的核外电子层数:B=C=2A可知,A为H元素,B、C为第二周期元素。原子的最外层电子数A=D,则D为Na元素。根据B元素的主要化合价:最高正价+最低负价=2可知。B为N元素。根据原子的最外层电子数:A+B=C可知,C为O元素。原子的最外层电子数:C=E可知,E为S元素。根据题中“某黑色含F的磁性氧化物”可知,F为Fe元素。
(1)A为H元素,B为N元素,甲为由A、B两种元素组成的常见气体,应为NH3。氨气是含有极性键的共价化合物,其电子式为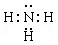 。
。
(2)黑色含F的磁性氧化物是四氧化三铁,其中Fe元素的化合价有+2价和+3价两种。E最高价氧化物对应水化物是硝酸,具有强氧化性,其稀溶液与四氧化三铁反应的离子方程式是Fe3O4+8H+=2Fe3++ Fe2++4H2O;根据装置1的构成可知,该装置是原电池,其中铁是负极,碳棒是正极。由于溶液是食盐水,所以发生的是钢铁的吸氧腐蚀,其中正极是氧气得到电子,其电极反应式是O2+2H2O+4e-=4OH-。
(3)A、B、C三种元素组成的盐为NH4NO2或NH4NO3,滴加AgNO3溶液生成白色沉淀,应为AgNO2沉淀,因为AgNO3溶于水,所以反应的化学方程式是NH4NO2 + AgNO3=AgNO2↓+NH4NO3;NH4NO2为强酸弱碱盐,水解呈酸性,所以溶液中离子浓度大小顺序为c(NO2->c(NH4+)>c(H+)>c(OH-)。
(4)复盐中三种离子的个数比为2:1:2,常见为(NH4)2Fe(SO4)2。其中有色离子是亚铁离子,亚铁离子具有还原性,其检验方法是取少量该复盐于试管中并加水溶解,滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色,证明有Fe2+(或加氢氧化钠溶液,出现白色沉淀迅速变成灰绿色,最终变成红褐色。或者滴加铁氰化钾溶液【K3[Fe(CN)6]】,立即有铁氰化亚铁的蓝色沉淀出现,反应式为:2Fe(CN)63-+Fe2+=Fe3[Fe(CN)6]2↓,证明有Fe2+。
本题难度:困难
3、选择题 下列几种微粒中,质子数和电子数均相等的是
A.Na+和Ne
B.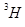 2O和
2O和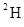 2O
2O
C.NH4+和NH3
D.H2SO4和H3PO4
参考答案:BD
本题解析:考查原子的组成。质子数等于核外电子数,所以A中质子数和电子数分别为11、10和10、10。B中质子数和电子数分别为10、10和10、10。C中质子数和电子数分别为11、10和10、10。D中质子数和电子数分别为50、50和50、50。因此答案是BD。
本题难度:一般
4、选择题 下列各组顺序的排列不正确的是
A.离子半径:Na+>Mg2+>Al3+>F-
B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性强弱:H3AlO3<H2SiO3<H2CO3<H3PO4
D.碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3
参考答案:A
本题解析:核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以A不正确,应该是F->Na+>Mg2+>Al3+。非金属性越强,氢化物的稳定性越强,最高价氧化物的水化物的酸性越强,BC正确;金属性越强,最高价氧化物的水化物的碱性越强,D正确,答案选A。
点评:该题是基础性试题的考查,难度不大,主要是考查学生灵活运用元素周期律解决实际问题的能力。该题的关键是熟练记住元素周期律的内容,然后结合题意灵活运用即可,有助于培养学生的逻辑推理能力。
本题难度:简单
5、选择题 A元素原子的L层电子数是K层电子数的两倍,B元素具有A元素相同的电子层数,且最外层电子数比A元素最外层电子数多两个,则A的同主族短周期元素与B形成的化合物是
A.CO2
B.NaCl
C.MgCl2
D.SiO2
参考答案:A
本题解析:A元素原子的L层电子数是K层电子数的两倍,则A是碳元素。B元素具有A元素相同的电子层数,且最外层电子数比A元素最外层电子数多两个,所以B是氧元素,因此答案选A。
本题难度:一般