1、选择题 五种短周期元素的原子半径及主要化合价如下表:
元素代号
| L
| M
| Q
| R
| T
|
原子半径/nm
| 0.160
| 0.143
| 0.104
| 0.111
| 0.066
|
主要化合价
| +2
| +3
| +6、-2
| +2
| -2
|
下列叙述正确的是
A.R与M的单质及其化合物有相似的化学性质
B.L、M的单质均用电解其熔融的盐的方法冶炼而得
C.T的氢化物还原性及稳定性均比Q的氢化物强
D.五种元素的常见简单离子中半径最大的是Q2-
参考答案:AD
本题解析:由各元素的主要化合价及原子半径规律可知:L与R为第IIA元素,分别为Mg、Be;Q、T为第VIA元素,分别为S、O;而M为铝元素
A:两元素遵循对角线规则,性质相似,正确
B:电解熔融的氯化镁制取镁,而冶炼铝是电解熔融的氧化铝,不正确
C:O的非金属性较S强,其氢化物的稳定性较强,但还原性较弱,不正确
D:各离子的电子层数最多的就是硫离子,正确
答案为AD
本题难度:一般
2、简答题 (13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25?镍0.5~1.5 钼0.3~0.6?锰0.8~1.6?碳0.3
(1)铬元素的基态原子的价电子层排布式是?。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
元?素
| Mn
| Fe
|
电离能
/kJ·mol-1
| I1
| 717
| 759
|
I2
| 1509
| 1561
|
I3
| 3248
| 2957
|
?
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是?。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
有?(填序号)。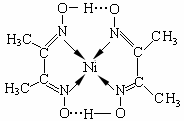
A.氢键? B.离子键? C.共价键? D.金属键? E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是? ?。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是? ?
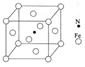
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,则该磁性材料的化学式为 ?
参考答案:(1)3d54S1?(2)?sp3?
(3)Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态。)
(4) ACE; ?N>O>C;?(5) 分子晶体?(6)Fe4N
本题解析:(1)原子处于全充满、半充满或全空时是稳定的状态。24号铬元素的基态原子的价电子排布式是3d54S1。(2)C元素Si元素组成的SiC晶体是原子晶体。其中的C原子的杂化方式为sp3。(3)根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态)。(4)在某镍配合物中含有共价键、配位键、氢键。选项为ACE。组成该配合物分子且同属第二周期元素有C、N、O。一般情况下,元素的非金属性越强,原子半径越小,元素的电负性就越大。但是对于N原子来说,由于其最外层电子处于半充满的稳定状态,所以失去电子需要的能量比O还多。因此这三种元素的电负性由大到小的顺序是N>O>C。(5) 根据四羰基镍的性质可推知该晶体所以分子晶体。(6)Fe:8×1/8+6×1/2=4;N:1。因此该磁性材料的化学式为Fe4N。
本题难度:一般
3、选择题 X、Y、Z均为元素周期表中前20号元素,mXa+、nYb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是?(?)
A.已知mXa+与nYb-,得m+a=n-b
B.离子半径:Yb->Z(b+1)-﹥Xa+
C.Z(b+1)-的还原性一定大于Yb-
D.气态氢化物的稳定性Hb+1Z一定大于HbY
参考答案:C
本题解析:mXa+、nYb-、Z(b+1)-离子的电子层结构相同,则核外电子数相同,即m-a=n+b,X处于Y、Z的下一周期,X为金属元素,Y、Z为非金属元素,X的原子序数大于Y的原子序数,Y的原子序数大于Z的原子序数,结合电子层结构相同核电荷数越大离子半径越小与元素周期律判断。
A项:根据上述分析,m-a=n+b,故错;B项:具有电子层结构相同的离子,核电核数越大半径越小,故错;D项:Y的非金属性大于Z的非金属性,故错。故选C。
点评:本题考查了半径比较、核外电子排布、结构与位置关系,难度不大,判断W、Y的位置关系是关键,要灵活运用元素周期律知识解答。
本题难度:简单
4、填空题 (13分)下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
族
周期
| I A
| IIA
| IIIA
| ⅣA
| VA
| ⅥA
| ⅦA
| 0
|
二
| ?
| ?
| ?
| ①
| ②
| ?
| ③
| ?
|
三
| ?
| ④
| ⑤
| ⑥
| ?
| ?
| ⑦
| ⑧
|
四
| ⑨
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
|
?
(1)在这些元素中,⑩原子的原子结构示意图为?。
(2)写出①的最高价氧化物和②的单质的电子式?,?。
(3)用电子式表示③与④形成化合物的过程?。
(4)①的单质和⑥的氧化物反应的化学方程式?。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:??
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:??。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出?kJ的热量。
参考答案:(1)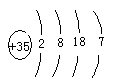
(2)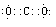
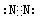
(3)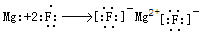
(4)2C+SiO2 ?Si+2CO↑;
?Si+2CO↑;
(5)2Al+2H2O +NaOH=2NaAlO2+3H2↑;Al(OH)3+OH-=AlO-2+2H2O。
(6)660
本题解析:(1)⑩原子是Br原子,核内有35个质子,原子结构示意图为 ;
;
(2)①的最高价氧化物是CO2,电子式为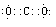 ;②的单质是N2,电子式为
;②的单质是N2,电子式为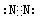 ;
;
(3)③与④形成化合物是MgF2,属于离子化合物,Mg失去2个电子成为镁离子,F得到1个电子成为氟离子,用电子式表示其形成过程是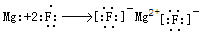 ;
;
(4)①的单质和⑥的氧化物反应即C与二氧化硅高温下发生置换反应,化学方程式为2C+SiO2 ?Si+2CO↑;
?Si+2CO↑;
(5)⑤是Al,与氢氧化钠反应的化学方程式为2Al+2H2O +NaOH=2NaAlO2+3H2↑;氢氧化铝是难溶物,书写离子方程式时不能拆开,属于氢氧化铝与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO-2+2H2O;
(6)甲烷与氧气燃烧的化学方程式为CH4+2O2 CO2+ 2H2O,根据反应热与化学键键能的关系,△H=(4×414+2×498-2×728-2×2×464)kJ/mol="-660" kJ/mol,所以1mol甲烷完全燃烧放出660kJ的热量。
CO2+ 2H2O,根据反应热与化学键键能的关系,△H=(4×414+2×498-2×728-2×2×464)kJ/mol="-660" kJ/mol,所以1mol甲烷完全燃烧放出660kJ的热量。
本题难度:一般
5、选择题 下列关于原子结构、元素性质的说法正确的是( )。
A.金属与非金属组成的化合物中只含离子键
B.ⅠA族的元素与VIIA族元素形成的化合物不一定是离子化合物。
C.不同原子组成的纯净物一定是化合物。
D.ⅠA 族元素的阳离子氧化性越强,其最高价氧化物对应水化物的碱性越强
参考答案:B
本题解析:金属与非金属组成化合物可能不含离子键,如: AlCl3等;也可能在含离子键时还有共价键,如: NaOH等,A错。ⅠA族的元素是H和碱金属,它们与卤素可能形成共价键,也可形成离子键,如:HCl、NaCl等,B对。C中不同原子不一定是不同元素,如:氕、氘、氚是不同原子,但都是氢元素,HD也是氢气是单质。而同一主族金属阳离子氧化性越强,元素的金属性越弱,其最高价氧化物对应水化物碱性越弱,D错。
本题难度:一般