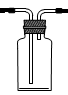
1、实验题 分某同学为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验

(1)B是用来收集实验中生成的气体的装置,但未将导管画全,请在答题卷上把导管补充
完整?。
(2)请写出铜跟浓硫酸反应的化学方程式?。
(3)实验中D中的现象?。
(4)实验中,该同学取6.4g铜片和12mL 18mol·L-1H2SO4溶液放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余;该同学根据所学的化学知识判断还会有一定量H2SO4的剩余,下列药品中能够用来验证反应停止后的烧瓶中确有剩余的H2SO4的是?填字母编号)。
a.BaCl2溶液? b.Ba(NO3)2溶液? c.银粉? d.Na2CO3粉末
(5)若将16g铜与50mLH2SO4物质的量浓度为一定值的浓硫酸反应,铜完全溶解。请回答:
①反应中产生的气体在标准状况下的体积为?L。
②该反应中被还原的H2SO4的物质的量为?mol。
③待产生的气体全部释放后,向溶液中滴加VmL a mol·L-1NaOH溶液,恰好使溶液中?
的Cu2+全部转化为沉淀,则原浓硫酸中H2SO4的物质的量浓度=?mol·L-1。
参考答案:
(1) (2)
(2)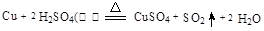
(3)紫色石蕊试液变红?(4)bd?(5)① 5.6;② 0.25;③(aV×10-2+5)
本题解析:(1)作图时B装置中导气管长进短出;(2)铜与浓硫酸反应生成二氧化硫和硫酸铜,注意配平;(3)二氧化硫溶于水,得到的的溶液显酸性?,紫色石蕊试液变红;(4)能够用来验证反应停止后的烧瓶中确有剩余的H2SO4的是b、d,a.反应后生成的硫酸铜中也含有硫酸根离子,能与BaCl2溶液生成白色沉淀,不能检验出硫酸的存在;b.如果溶液中有硫酸剩余,加入Ba(NO3)2溶液,除了生成白色硫酸钡沉淀,还会在烧瓶口处观察到红棕色的NO2气体,故能检验出硫酸的存在;c.加入银粉没有明显变化,不能检验出硫酸的存在;d.如果溶液中有硫酸剩余,加入Na2CO3粉末会生成无色的CO2气体,故能检验出硫酸的存在;(5)①根据铜的质量,利用铜与硫酸反应的化学方程式计算;②根据元素守恒,被还原的H2SO4的物质的量等于生成SO2的物质的量;③“恰好使溶液中的Cu2+全部转化为沉淀”,则此时,溶液为Na2SO4溶液,根据硫元素守恒,则硫酸的物质的量:n(H2SO4)=n(Na2SO4)+n(SO2)=n(NaOH)×1/2+n(SO2),然后根据c=n/V(aq)计算。
本题难度:一般
2、实验题 某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:

(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为?; C中反应的离子方程式为?
(2)为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是?
(3)试验中发现Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00g产品,配成100ml溶液,移取25.00ml溶液,用0.20mol/L酸性KMnO4溶液进行滴定,消耗KMnO4溶液20.00mL,产品中Na2SO3质量分数的计算表达式为?,计算结果为?。(保留两位小数)
参考答案:(1)品红溶液?
SO2 + I2 + 2H2O ="=" SO42- +2 I- +4 H+
(2)不用加热;相对安全;易于控制反应进行;反应更充分。(任何合理的一点均给分)
(3)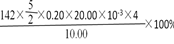 ? 50.4%
? 50.4%
本题解析:(1)B中是检验SO2的漂白性用的是品红溶液;C中检验SO2的还原性,反应的离子方程式为SO2 + I2 + 2H2O ="=" SO42- +2 I- +4 H+。
(2)A2与启普发生器的原理相似,优点为不用加热;相对安全;易于控制反应进行;反应更充分。
(3)考查的是滴定实验及相关计算。
点评:本题主要考查计算能力、分析能力、实验设计能力,要求较高,需要扎实的基础知识作依托,尤其是检验从接触室出来的气体成分需要有对知识的综合运用和迁移能力。
本题难度:一般
3、填空题 假设116号元素存在,完成下列问题:?
(1)116号元素在元素周期表中的位置是___________________________________。?
(2)下列关于116号元素的说法中正确的是_________________。?
A.无氧酸钠盐的化学式为Na2R的形式?
B.最高价氧化物可能是碱性氧化物?
C.原子的近似相对原子质量必定为332?
参考答案:(1)第七周期、ⅥA族 (2)B
本题解析:已知元素的原子序数判断元素在周期表中的位置,方法之一是参照ⅠA族和0族元素原子序数法。元素周期表第七周期的ⅠA族元素原子序数为87,0族元素原子序数为118,87<116<118。故116号元素在周期表的第七周期、倒数第三个族——ⅥA族。
周期表第ⅥA族第五周期的元素碲虽然为非金属元素,但有一定的金属性,如单质碲为银白色、能导电。根据周期表同主族内元素性质变化的规律判断可知,116号元素是金属元素,且其金属性较强或很强。金属元素的最高价氧化物可能是碱性氧化物,但它不存在无氧酸,自然就没有Na2R这种形式的盐。
原子的近似相对原子质量就是原子的质量数。元素原子序数是116,该元素中可能有同位素,或者说该元素可能包括两种或更多种不同的核素。在现有条件下,不能确定该元素中任何一种核素原子核内的中子数,也就不能确定原子的近似相对原子质量。
本题难度:简单
4、选择题 下列对二氧化硫气体的物理性质或化学性质描述正确的有
A.无色、无味
B.容易液化、难溶于水
C.有漂白性,能使品红溶液褪色
D.和水反应生成硫酸
参考答案:C
本题解析:A 错误,无色、有刺激性气味
B 错误,难液化、易溶于水
C 正确。
D 错误,和水反应生成亚硫酸
本题难度:一般
5、选择题 下列说法不正确的是
A.硫酸厂应该建在靠近原料产地的地区
B.接触法制硫酸的主要步骤是造气、接触氧化和三氧化硫的吸收
C.由于常压下SO2转化为SO3的转化率很高,所以SO2接触氧化时不采用高压的反应条件
D.工业“三废”的综合利用不仅能减少污染,还获得有用的副产品
参考答案:A
本题解析:此题考查硫酸的工业制法。
A项硫酸厂的选址,应距消费部门(或城市)较近,综合评估有较好经济效益处;B项中“造气”是指通过煅烧硫铁矿或燃烧单质硫来获得SO2气体;C项要让学生知道“常压”下SO2转化为SO3的转化率在90%以上,防止在方程式书写时将“高温、催化剂”写成“高温、高压、催化剂”。
本题难度:简单