1、计算题
(1)按反应中的理论值,SO2和O2的体积比为2:1,但实际生产中这个比值是多少?为什么?
(2)?通过计算说明为什么尾气以5 m3/h的速率与20 L/h速率的氨气混合?
(3)?若该厂每天排放10000 m3尾气,求该厂每月(按30天计算)可得到(NH4)2SO4的质量为多少?
2、选择题 如图所示,小试管中盛有几毫升水,与大试管连通的U形细玻管内放有少量的水(已染成红色)。如沿小试管壁小心地慢慢注入3 mL浓硫酸,静置片刻后,U形细玻管中可观察到的液面现象是(?)

图4-14
A.左高右低
B.左低右高
C.左右一样高
D.来回振动
3、填空题 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
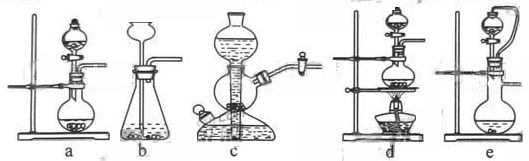
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是?(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠?g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠?g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
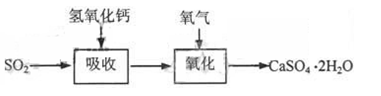
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
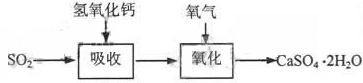
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:

已知:
试剂
| Ca(OH)2
| NaOH
|
价格(元/kg)
| 0.36
| 2.9
|
吸收SO2的成本(元/mol)
| 0.027
| 0.232
|
?
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是?。和碱法相比,石灰-石膏法的优点是?,缺点是?。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
4、实验题 (16分)硫代硫酸钠(Na2S2O3)是最重要的硫代硫酸盐,俗称“海波”,又名“大苏打”。易溶于水,不溶于乙醇。在棉织物漂白、定量分析中有广泛应用。
某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
【样品制备】实验室中常用亚硫酸钠和硫磺制备Na2S2O3·5H2O。写出反应的化学方程式????;
反应液经脱色、过滤、浓缩结晶、过滤、洗涤、干燥即得产品。所得晶体用乙醇洗涤的目的是???;
【提出问题】Na2S2O3是否与Na2SO4具备相似的下列性质呢?
猜想①:?;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
【性质探究】基于上述猜想②、③,设计实验方案。
?
| 实验操作
| 实验现象或
预期实验现象
| 现象解释(用
离子方程式表示)
|
猜想②
| ???,将试纸与标准比色卡对照?
| 溶液pH=8
| ?
|
向pH=2的硫酸中
滴加Na2S2O3溶液
| ?
| 2S2O32- +2H+══ S↓+SO2↑+H2O
|
猜想③
| 向新制氯水中滴加少量Na2S2O3溶液
| 氯水颜色变浅
| ?
|
?
【实验结论】
Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由:?。
(2)请重新设计一个实验方案,证明Na2S2O3具有还原性。你的实验方案是:?。
5、选择题 下列关于浓硫酸和浓硝酸的叙述,属于二者共同具有的性质是
A.具有吸水性,可做干燥剂
B.可用作氧化剂
C.其钡盐难溶于水
D.能与浓盐酸按一定比例混合,所得的混合酸可溶解铂和金