1、计算题
(1)按反应中的理论值,SO2和O2的体积比为2:1,但实际生产中这个比值是多少?为什么?
(2)?通过计算说明为什么尾气以5 m3/h的速率与20 L/h速率的氨气混合?
(3)?若该厂每天排放10000 m3尾气,求该厂每月(按30天计算)可得到(NH4)2SO4的质量为多少?
参考答案:(1)根据2SO2+O2≒?2?SO3,SO2和 O2按2:1(体积比)的理论值反应,但实际上v(SO2):v(O2)=0.2%:10%=1:50。根据化学平衡移动原理,增大廉价的氧气的浓度,可使反应:2SO2(g)+O2(g) ≒?2?SO3(g)向生成三氧化硫方向移动,这样可以增大较贵重的二氧化硫的转化率。
(2)?2NH3?~?SO2
2?1
V(NH3)? 5×103×0.2%L/h? v(NH3)=20L/h
(3)根据2SO2+O2≒?2?SO3,以及SO3+H2O+2NH3=(NH4)2SO4
得关系式:? SO2?~ 2NH3~(NH4)2SO4
22.4L? 132g
107L×0.2%×30? m[(NH4)2SO4]
m[(NH4)2SO4]=3.54×106g=3.54t
本题解析:(1)根据2SO2+O2≒?2?SO3,SO2和 O2按2:1(体积比)的理论值反应,但实际上v(SO2):v(O2)=0.2%:10%=1:50。根据化学平衡移动原理,增大廉价的氧气的浓度,可使反应:2SO2(g)+O2(g) ≒?2?SO3(g)向生成三氧化硫方向移动,这样可以增大较贵重的二氧化硫的转化率。
(3)?2NH3?~?SO2
2?1
V(NH3)? 5×103×0.2%L/h? v(NH3)=20L/h
(3)根据2SO2+O2≒?2?SO3,以及SO3+H2O+2NH3=(NH4)2SO4
得关系式:? SO2?~ 2NH3~(NH4)2SO4
22.4L? 132g
107L×0.2%×30? m[(NH4)2SO4]
m[(NH4)2SO4]=3.54×106g=3.54t
本题难度:一般
2、选择题 如图所示,小试管中盛有几毫升水,与大试管连通的U形细玻管内放有少量的水(已染成红色)。如沿小试管壁小心地慢慢注入3 mL浓硫酸,静置片刻后,U形细玻管中可观察到的液面现象是(?)

图4-14
A.左高右低
B.左低右高
C.左右一样高
D.来回振动
参考答案:B
本题解析:浓硫酸与少量的水接触后立即放出大量的热,使整个密闭系统的温度升高,压强增大,U形管中液柱被压向右侧,液面左低右高。
本题难度:简单
3、填空题 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
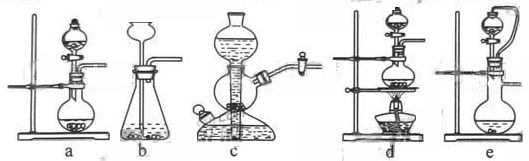
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是?(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠?g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠?g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
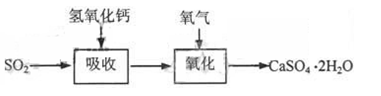
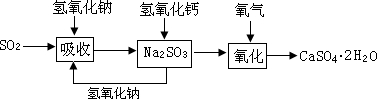
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
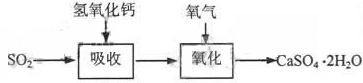
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:

已知:
试剂
| Ca(OH)2
| NaOH
|
价格(元/kg)
| 0.36
| 2.9
|
吸收SO2的成本(元/mol)
| 0.027
| 0.232
|
?
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是?。和碱法相比,石灰-石膏法的优点是?,缺点是?。
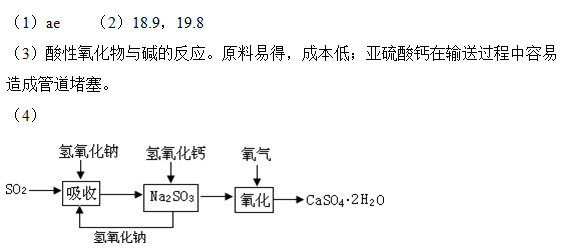
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
参考答案:
本题解析:(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的;
(2)? H2SO4+Na2SO3=Na2SO4+SO2+H2O
126g? 22.4L
m? 3.36L
m=18.9g
4g亚硫酸钠被氧化为硫酸钠后的质量变为4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中,亚硫酸钠的质量分数为95.5%,因此称取样品的质量为19.8g。
(3)石灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等,但因Ca(OH)2碱性弱,导致吸收速率慢、效率低;
(4)依据上述流程操作存在的缺点,能实现物料循环的烟气脱硫方案
本题难度:一般
4、实验题 (16分)硫代硫酸钠(Na2S2O3)是最重要的硫代硫酸盐,俗称“海波”,又名“大苏打”。易溶于水,不溶于乙醇。在棉织物漂白、定量分析中有广泛应用。
某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
【样品制备】实验室中常用亚硫酸钠和硫磺制备Na2S2O3·5H2O。写出反应的化学方程式????;
反应液经脱色、过滤、浓缩结晶、过滤、洗涤、干燥即得产品。所得晶体用乙醇洗涤的目的是???;
【提出问题】Na2S2O3是否与Na2SO4具备相似的下列性质呢?
猜想①:?;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
【性质探究】基于上述猜想②、③,设计实验方案。
?
| 实验操作
| 实验现象或
预期实验现象
| 现象解释(用
离子方程式表示)
|
猜想②
| ???,将试纸与标准比色卡对照?
| 溶液pH=8
| ?
|
向pH=2的硫酸中
滴加Na2S2O3溶液
| ?
| 2S2O32- +2H+══ S↓+SO2↑+H2O
|
猜想③
| 向新制氯水中滴加少量Na2S2O3溶液
| 氯水颜色变浅
| ?
|
?
【实验结论】
Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由:?。
(2)请重新设计一个实验方案,证明Na2S2O3具有还原性。你的实验方案是:?。
参考答案:
【样品制取】Na2SO3 + S + 5H2O ══Na2S2O3·5H2O?除去可溶性杂质,减少产品的溶解损耗
【提出问题】与BaCl2溶液反应有沉淀生成
【性质探究】用玻璃棒蘸取Na2S2O3溶液,点滴到pH试纸的中央,有淡黄色沉淀和无色刺激性气味气体产生? S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
【问题讨论】
(1)不正确,因氯水中本来就含有Cl-
(2)在少量Na2S2O3溶液中滴入氯水,然后滴入氯化钡溶液,若观察到白色沉淀产生,加入盐酸后不溶解,则说明Na2S2O3能被氯水氧化
本题解析:【样品制取】:明确反应物是Na2SO3、S ,生成物是Na2S2O3·5H2O,可快速书写出化学反应方程式;由已知:“易溶于水,不溶于乙醇”,说明乙醇的作用是除去杂质、减少损耗。
【提出问题】硫酸钠与氯化钡反应生成白色沉淀,猜想Na2S2O3与BaCl2溶液反应有沉淀生成;
【性质探究】根据盐类水解的规律,无弱不水解,有弱才水解,越弱越水解,谁强显谁性,Na2S2O3为
强碱弱酸盐,水解呈碱性,用PH试纸测溶液的PH;
向pH=2的硫酸中滴加Na2S2O3溶液,硫代硫酸钠和硫酸反应生成二氧化硫气体和硫单质,Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O;
根据氧化还原反应的实质得失电子守恒,S2O32-→2SO42-~8e-,Cl2→2CI-~2e-,所以4molCl2氧化1molS2O32-,得到8molCl-和2molSO42-,根据电荷守恒,生成物中应有10molH+,根据原子守恒反应物中应有5molH2O,离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+。
【问题讨论】(1)氯水的成分中含有氯离子,可以和AgNO3溶液反应产生白色沉淀。
(2)Na2S2O3被氯水氧化生成硫酸根离子,硫酸根检验时要排除碳酸根离子和亚硫酸根离子的干扰,所以加入用盐酸酸化的氯化钡溶液,如果有白色沉淀产生,则证明含有硫酸根离子,反之则没有。
考查了物质的检验,要求会根据题中给予信息分析问题、解决问题,题目难度中等.
本题难度:一般
5、选择题 下列关于浓硫酸和浓硝酸的叙述,属于二者共同具有的性质是
A.具有吸水性,可做干燥剂
B.可用作氧化剂
C.其钡盐难溶于水
D.能与浓盐酸按一定比例混合,所得的混合酸可溶解铂和金
参考答案:B
本题解析:略
本题难度:一般