-
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
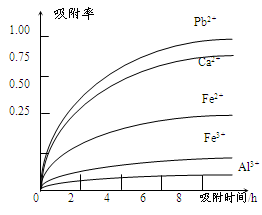
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
参考答案:(1)SO2+MnO2=MnSO4 (2)2Fe2
本题解析:
试题分析:(1)根据题意在浸出过程中生成Mn2+反应的化学方程式为SO2+MnO2=MnSO4;(2)将Fe2+氧化为Fe3+过程中主要反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计。使Fe3+沉淀完全的pH为3.7,而Mn2+开始形成沉淀的pH为8.3。因此应调节pH的范围为4.7 ≤pH<8.3。(4)根据题目提供的表格数据可知决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径 、金属离子的电荷;吸附步骤除去的主要离子为Pb2+、Ca2+。(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol/LCaCl2溶液与2.00×10—2 mol/LNa2SO4溶液等体积混合,由于忽略体积的变化,所以混合后氯化钙和硫酸钠溶液的浓度都要减半;c(SO42-)=1.00×10—2 mol/L. c(Ca2+)=c/2mol/L.由于Ksp(CaSO4)= 9.10×10—6,c(SO42-)·c(Ca2+)≥9.10×10—6,则生成沉淀时c(Ca2+)≥(9.10×10—6÷1.00×10—2 mol/L)×2=1.82×10-3mol/L。因此c的最小值是1.82×10-3mol/L.
考点:考查化学反应原理、影响离子吸收的因素及沉淀溶解平衡和溶度积的计算的知识。
本题难度:困难
2、选择题 下列反应的离子方程式书写正确的是
A.盐酸与氢氧化钠溶液反应: H++OH-=H2O
B.锌粒与稀醋酸反应: Zn+2H+=Zn2++H2↑
C.氯化镁溶液与氨水反应: Mg2++2OH-=Mg(OH)2↓
D.氯气与氢氧化钠溶液反应: Cl2+OH-=Cl-+ClO-+H2O
参考答案:A
本题解析:
试题分析:醋酸是弱酸,应该用化学式表示,B不正确;氨水是弱碱,应该用化学式表示,C不正确;D中没有配平,应该是Cl2+2OH-=Cl-+ClO-+H2O,答案选A。
考点:考查离子方程式的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:一般
3、选择题 下列反应能用CO32- + 2H+ = CO2 ↑ + H2O表示的是
A.Na2CO3 + H2SO4= Na2SO4+ CO2 ↑ + H2O
B.CaCO3 + 2HCl =CaCl2 + CO2 ↑+ H2O
C.KHCO3 + HCl =" KCl" + CO2 ↑ + H2O
D.BaCO3 + 2HNO3 =Ba(NO3 )2+ CO2 ↑ + H2O
参考答案:A
本题解析:
试题分析:除了A以外,其他的离子方程式表示如下:B.CaCO3 + 2H+ =Ca2+ + CO2 ↑+ H2O;C.HCO3-+ H+ = CO2 ↑ + H2O;D.BaCO3 + 2H+=Ba2+ + CO2 ↑ + H2O;答案选A。
考点:考查离子方程式的意义。
本题难度:一般
4、选择题 下列离子方程式书写正确的是( )
A.铝片放入NaOH溶液中:2Al+2OH-===2AlO2-+H2↑
B.碳酸钙溶于醋酸中:CaCO3+2H+===Ca2++CO2↑+H2O
C.氯气通入NaOH稀溶液中:Cl2+2OH-===Cl-+ClO-+H2O
D.Ba(OH)2溶液与过量NaHSO4溶液混合:H++SO42-+Ba2++OH-===BaSO4↓+H2O
参考答案:C
本题解析:考查离子方程式的正误判断。选项A不正确,反应物还有水参加;醋酸是弱电解质,应该有化学式表示;选项D不正确,应该是2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O,所以正确的答案是C。
本题难度:困难
5、选择题 下列离子方程式书写正确的是
A.铝片放入NaOH溶液中:2Al+2OH-+6H2O="2[" Al(OH)4]-+3H2↑
B.NaHCO3电离:NaHCO3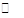 Na++ H++CO32- Na++ H++CO32-
C.醋酸与碳酸钠反应:2H++CO32-= CO2↑+H2O
D.铜与氯化铁溶液反应:Fe3+ + Cu = Cu2+ + Fe2+
参考答案:A
本题解析:
试题分析:NaHCO3属于钠盐强电解质,电离方程式为NaHCO3 =Na++HCO3-,B项错误;醋酸是弱酸,写化学式,C项错误;不符合电荷守恒,应该是2Fe3+ + Cu = Cu2+ + 2Fe2+,D项错误;选A。
考点:考查离子方程式的正误判断
本题难度:一般
|