微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式中,正确的是
A.稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑
B.碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C.硫酸铜溶液与氢氧化钠溶液混合:CuS04+20H-=Cu(OH)2↓+SO42-
D.硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-=AgCl↓+N03-
参考答案:B
本题解析:
试题分析:A.铁与稀硫酸反应生成亚铁离子不是铁离子,故A错误;B.碳酸氢钠电离出碳酸氢根离子,与盐酸电离的氢离子反应,生成了水和二氧化碳,故B正确;C.硫酸铜能完全电离,故应拆成离子形式,故C错误;D.硝酸银为强电解质,应拆成离子形式,故D错误。
考点:离子方程式的判断。
本题难度:一般
2、填空题 为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
水解反应
| 平衡常数(K)
|
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+
| 7.9 × 10-4
|
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+
| 3.2 × 10-10
|
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+
| 3.2 × 10-7
请回答:(1)稀硝酸和Cu反应的化学方程式为 。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。
方案: 。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
实验内容
| 实验现象
| 甲同学的实验方案
| 溶液逐渐变成蓝绿色, pH略有上升
| 乙同学的实验方案
| 无明显现象,pH没有明显变化。
①据实验现象写出发生反应的离子方程式: 。
②导致实验过程中溶液pH略有上升的可能原因是 。
③解释乙同学的实验现象 。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的: 。
参考答案:(1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2
本题解析:
(1)稀硝酸和Cu反应的化学方程式为3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(2)乙同学认为Fe(NO3)3溶液具中的NO3-也能氧化Cu,据此设计对照实验,配制pH与Fe(NO3)3溶液相同但只含NO3-不能氧化CuNO3-不含Fe3+的溶液即可,将铜放入该溶液中,观察二者是否反应
(3)①根据丙同学的实验证明甲同学的结论是正确的,发生的离子反应方程式为Cu + 2Fe3+ = Cu2+ + 2Fe2+②根据水解反应的平衡常数知Fe3+水解程度最大,溶液的pH略有上升,说明Fe3+变为Cu2+和Fe2+浓度减小,水解能力下降
③乙同学的实验现象说明在Fe(NO3)3溶液的酸性条件下,NO3-不能氧化Cu
(4)甲同学的实验中,NO3-造成干扰,将原溶液中的NO3-换成其他易溶盐的酸根离子即可证明
本题难度:一般
3、简答题 (10分)(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液中,设由水电离产生的OH-的物质的量浓度分别为A和B,则A________B(填“>”、“=”或“<”)。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若向该溶液中再滴入过量的BaCl2溶液,所观察到的现象是_________________________,其原因是_________________________。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是_______________。
②若为弱酸强碱盐,其第一步水解的离子方程式是___________________________。
参考答案:(10分)(1);<
(2)产生白色沉淀,红色逐渐褪去
本题解析:
试题分析:(1)氢氧化钠溶液中,存在大量的氢氧根离子,对水的电离起抑制作用,而醋酸钠溶液中,醋酸根离子水解,对水的电离起促进作用,所以水电离产生的氢氧根离子的浓度A<B;
(2)纯碱为碳酸钠,因为碳酸根离子水解使溶液呈碱性,所以加入酚酞试液变红色,再滴入氯化钡溶液,因为钡离子与碳酸根离子结合为碳酸钡沉淀,使碳酸根离子的浓度减小,碳酸根离子的水解平衡逆向移动,溶液的碱性减弱,所以红色逐渐褪去,且产生白色沉淀;
(3)对于强酸弱碱盐水解时,弱碱的阳离子水解的离子方程式一步写成,所以水解的离子方程式是An++nH2O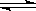 A (OH)n+nH+;对于弱酸强碱盐水解时,弱酸根离子的水解是分步写的,所以第一步水解的离子方程式是Bm-+H2O A (OH)n+nH+;对于弱酸强碱盐水解时,弱酸根离子的水解是分步写的,所以第一步水解的离子方程式是Bm-+H2O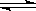 HB (m-1)-+OH-。 HB (m-1)-+OH-。
考点:考查条件对水电离的影响,水解离子方程式的书写
本题难度:困难
4、选择题 下列离子方程式书写正确的是
A.硫酸镁溶液跟氢氧化钡溶液反应: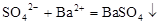
B.NaHCO3溶液与NaOH溶液反应:OH
参考答案:
本题解析:
本题难度:一般
5、填空题 (12分)写出下列反应的离子方程式
(1)过氧化钠与水
(2)金属铝与稀硫酸溶液
(3)向Na2CO3与NaHCO3混和溶液加入CaCl2溶液
(4)Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个离子方程式表示有关生成H2的变化:
(A)
(B)
(5)把铜片放入稀硝酸中: ;
参考答案:(每空2分共12分)
(1)2Na2O2+2H2O=2
本题解析:离子方程式的书写重点是“拆”,保证电荷、原子及电子得失的守恒
(1)氧化物不能拆:2Na2O2+2H2O=2Na++4OH-+O2↑
(2)金属与酸的置换氢气反应:
(3)只能生成CaCO3沉淀:Ca2++CO32-===CaCO3↓
(4)首先钠与水生成NaOH:2Na+2H2O=2Na++2OH-+H2↑
铝与NaOH反应:2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
由题意可知,碱液绝对过量,铝全部溶于碱液
(5)硝酸被还原为NO气体:3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O
本题难度:简单
|
|