微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
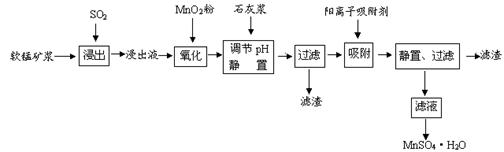
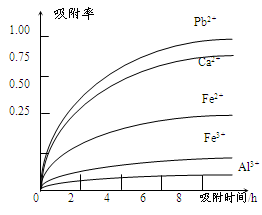
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
离子
| 离子半径(pm)
| 开始沉淀
时的pH
| 完全沉淀
时的pH
|
Fe2+
| 74
| 7.6
| 9.7
|
Fe3+
| 64
| 2.7
| 3.7
|
Al3+
| 50
| 3.8
| 4.7
|
Mn2+
| 80
| 8.3
| 9.8
|
Pb2+
| 121
| 8.0
| 8.8
|
Ca2+
| 99
| -
| -
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
2、选择题 下列反应的离子方程式书写正确的是
A.盐酸与氢氧化钠溶液反应: H++OH-=H2O
B.锌粒与稀醋酸反应: Zn+2H+=Zn2++H2↑
C.氯化镁溶液与氨水反应: Mg2++2OH-=Mg(OH)2↓
D.氯气与氢氧化钠溶液反应: Cl2+OH-=Cl-+ClO-+H2O
3、选择题 下列反应能用CO32- + 2H+ = CO2 ↑ + H2O表示的是
A.Na2CO3 + H2SO4= Na2SO4+ CO2 ↑ + H2O
B.CaCO3 + 2HCl =CaCl2 + CO2 ↑+ H2O
C.KHCO3 + HCl =" KCl" + CO2 ↑ + H2O
D.BaCO3 + 2HNO3 =Ba(NO3 )2+ CO2 ↑ + H2O
4、选择题 下列离子方程式书写正确的是( )
A.铝片放入NaOH溶液中:2Al+2OH-===2AlO2-+H2↑
B.碳酸钙溶于醋酸中:CaCO3+2H+===Ca2++CO2↑+H2O
C.氯气通入NaOH稀溶液中:Cl2+2OH-===Cl-+ClO-+H2O
D.Ba(OH)2溶液与过量NaHSO4溶液混合:H++SO42-+Ba2++OH-===BaSO4↓+H2O
5、选择题 下列离子方程式书写正确的是
A.铝片放入NaOH溶液中:2Al+2OH-+6H2O="2[" Al(OH)4]-+3H2↑
B.NaHCO3电离:NaHCO3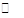 Na++ H++CO32- Na++ H++CO32-
C.醋酸与碳酸钠反应:2H++CO32-= CO2↑+H2O
D.铜与氯化铁溶液反应:Fe3+ + Cu = Cu2+ + Fe2+
|