微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应4A(g)+5B(g)==4C(g)+6D(g),在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.30mol。下列叙述正确的是?
[? ]
A.A的平均反应速率是0.010 mol·L-1·s-1?
B.容器中含D物质的量至少为0.45 mol?
C.容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D.容器中A的物质的量一定增加了0.30mol
2、选择题 把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:
3P(g)+Q(g) xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是(?)
xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是(?)
A.5min内P的平均反应速率为0.15mol/(L·min)
B.Q的转化率为25%
C.Q的平衡浓度为1mol/L
D.x是2
3、选择题 二氧化氮能形成二聚分子:2NO2(g)  ?N2O4(g)?△H<0。现欲测定二氧化氮的相对分子质量,应采取的措施是?(?)
?N2O4(g)?△H<0。现欲测定二氧化氮的相对分子质量,应采取的措施是?(?)
A.低温、高压
B.低温、低压
C.高温、低压
D.高温、高压
4、填空题 恒温、恒压下,在一个可变容积的容器中发生如下发应:A(气)+B(气)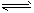 C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成amol C,这时A的物质的量为___________mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为___________mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则
x=___________mol,y=___________mol。平衡时,B的物质的量___________(选填一个编号)
(甲)大于2 mol (乙)等于2 mol (丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是___________。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是___________。若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较___________(选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是___________。
5、填空题 工业制硫酸的核心反应是 :2SO2(g)+ O2(g) 2SO3(g) ΔH<0,回答下列问题:
2SO3(g) ΔH<0,回答下列问题:
(1)此反应的平衡常数表达式为K=_______________,随着温度的升高,上述平衡常数_______(填“增大”、“减小”或“不变”)。
(2)将一定量的SO2(g)和O2(g)放入1 L密闭容器中,在一定条件下达到平衡,测得SO2为0.11 mol,O2
为0.05 mol,SO3为0.12 mol。计算该条件下,SO2转化为SO3转化率=_________。(结果保留一位小数)
(3)体积不变的条件下,下列措施中有利于提高SO2的转化率的是_____________(填字母)。
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(4)工业制硫酸的尾气中含有少量SO2 ,可用氨水吸收。反应的化学方程式为________________________________。